** § 2.7 Понятие о квантовой теории строения атома. Атомные спектры. Квантовые числа.
Одним из инструментов, который помог "заглянуть" внутрь невидимых, микроскопических атомов, послужила квантовая теория. В предыдущих разделах вы уже познакомились со многими понятиями, которыми эта теория оперирует (ядро, электронное облако, уровни, подуровни, орбитали, электронная конфигурация, минимум энергии и т.д.). Полезно еще раз вернуться к вопросу о том, как появились эти понятия, какие экспериментальные факты заставили исследователей нарисовать именно такую, а не иную картину строения атома.
Для начала нам придется разобраться в свойствах волн. Обычные волны (например, волны на воде) и электромагнитные волны (например, солнечный свет), имеют некоторые похожие свойства.
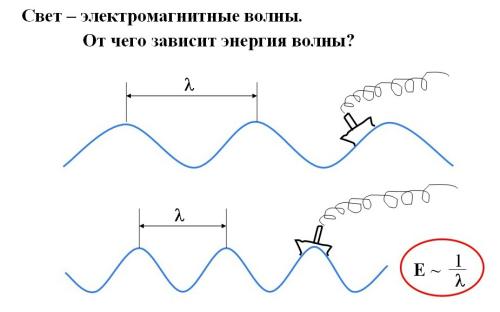
Представим плывущее по океанским волнам тяжелое грузовое судно. В настоящем океане по водной поверхности движется одновременно много волн. Мы с вами рассмотрим упрощенный случай: пусть по морю бежит одна-единственная волна с одинаковыми расстояниями между гребнями. Например, такая, как в верхней части рис. 2-10.

Рис. 2-10. Мысленный опыт с океанскими волнами, показывающий связь между длиной (λ), частотой (ν) и энергией (Е) волны. Чем меньше длина волны (λ), тем больше частота подъемов на гребень (ν) и энергия волны (E). Таким образом, энергия волны E = kν, где k – коэффициент пропорциональности.
Когда гребень волны прокатывается под кораблем, тяжелое судно поднимается вверх. Значит, волна способна совершать работу. Допустим, морская волна в верхней части рис. 2-10 достаточно пологая, а морская волна в нижней части рисунка – более частая, похожая на зыбь. При этом пусть высота волн в обоих случаях будет одинаковой, чтобы одинаковой была и высота подъема судна на волне. Тогда получится, что нижняя волна совершает больше работы: на ее гребнях корабль поднимается в единицу времени чаще.
Чем больше расстояние между гребнями волны, тем меньшее число раз поднимается корабль в единицу времени. Расстояние между гребнями волны называется длиной волны и обозначается греческой буквой λ (лямбда). Частота волны – это число подъемов судна на гребень волны в единицу времени, обозначается буквой ν (ню).
Итак, поднимая корабль вверх, волна совершает работу. Значит, чем меньше длина волны (или чем больше частота), тем большую энергию несет волна. Энергия волны Е пропорциональна ее частоте: Е = kν, где k – некая константа, которую можно определить экспериментально.
Свет, испускаемый нагретыми телами (например, Солнцем), также представляет собой волновые колебания электрической и магнитной энергии. Чем больше частота такой электромагнитной волны, тем большую энергию она несет. Волны света с разной энергией оказывают разное влияние на сетчатку глаза. Световые волны высокой частоты воспринимаются нами как фиолетовые. Если постепенно уменьшать частоту (увеличивать длину волны света), то цвет становится сначала синим, потом голубым, зеленым, желтым, оранжевым и, наконец, красным. Красный свет несет меньше всего энергии.
Солнечный свет выглядит белым потому, что в нем смешаны электромагнитные волны всех частот. Если с помощью стеклянной или кварцевой призмы разложить солнечный свет на составляющие его волны, то мы увидим красивую радугу, называемую солнечным спектром (рис. 2-11).
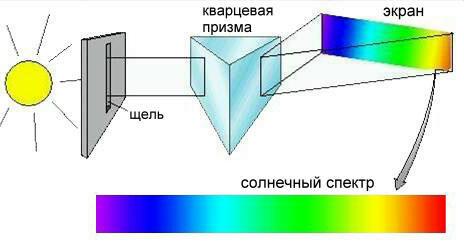
Рис. 2-11. Спектр солнечного излучения, полученный с помощью простейшего спектрометра.
Прибор, изображенный на рис. 2-11, называется спектрометром. Спектр электромагнитного излучения на самом деле гораздо шире, чем может увидеть человеческий глаз (рис. 2-12).
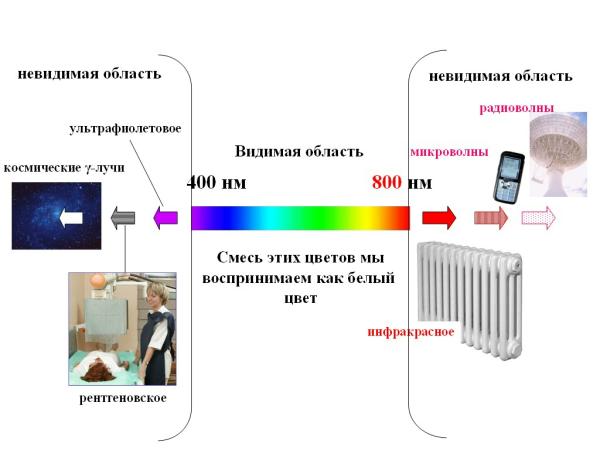
Рис. 2-12. Длины волн и названия некоторых видимых и невидимых областей солнечного спектра.
Левее видимой области находится невидимая глазу ультрафиолетовая область спектра. Еще левее находятся очень коротковолновые рентгеновские лучи и совсем коротковолновые космические лучи, которые несут так много энергии, что опасны для живых организмов. К красной области примыкает невидимая инфракрасная область спектра, затем следуют микроволновая и радиоволновая области. Эти волны несут меньше энергии, чем видимый и ультрафиолетовый свет.
Длины волн измеряются в метрах (радиоволны), сантиметрах (микроволны) и чаще всего в нанометрах (видимая и ультрафиолетовая области). Нанометр (нм) – миллиардная часть метра (1 нм = 10-9 м). Видимая человеку область спектра простирается примерно от 400 до 800 нм (рис. 2-12).
Нагретые тела испускают свет, потому что это позволяет им избавиться от избытка энергии. Привычный нам дневной свет испускается поверхностью Солнца, разогретой до 6000 оС.
Если кусок железа нагревать на сильном огне, он начинает светиться сначала темно-вишневым, а потом красным светом. Точно так же другие элементы в сильно разогретом состоянии могут испускать свет, который можно разложить на составляющие его волны с помощью спектрометра.
Такие спектры называются спектрами испускания. Спектр испускания водорода (рис. 2-13) оказался не сплошным, как у солнечного света, а линейчатым. Обнаруженное явление требовало объяснения, которое долгое время не могли найти.
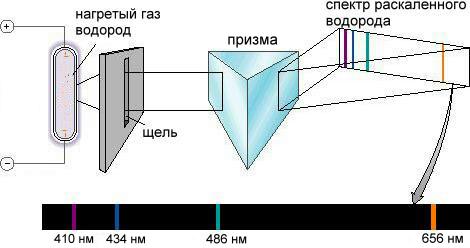
Рис. 2-13. Спектр испускания раскаленного атомарного водорода. Водород в так называемой водородной лампе разогревается сильным электрическим разрядом. Испускаемый атомами водорода свет, пройдя через призму, дает спектр, состоящий из отдельных линий. На рисунке показана только видимая область спектра. Позже, с совершенствованием спектрометров, были открыты серии линий в ультрафиолетовой и в инфракрасной области.
Еще до опытов Резерфорда, когда о строении атома было известно мало, физики упорно искали ответ на вопрос: каким образом нагретое вещество испускает свет? Предполагалось, что свет возникает в результате колебаний групп атомов и частота этих колебаний как-то связана с частотой волны испускаемого света. Но как устроен атом и почему его колебания приводят к излучению? Эти (и не только эти) вопросы заставляли исследователей предлагать различные гипотезы строения атома.
Уже были получены первые экспериментальные данные о заряженных частицах – электроне и протоне. Разумеется, в тот момент вряд ли кто-нибудь мог с уверенностью сказать, что эти частицы имеют отношение к строению атома, но открытие электрона и предположение о существовании протона уже позволяли выдвигать гипотезы о внутреннем устройстве атомов на основе этих "строительных деталей". Именно тогда появилась модель атома, которую предложил Дж. Дж. Томсон, а чуть позже – модель атома, предложенная Э. Резерфордом (рис. 2-3 а и б).
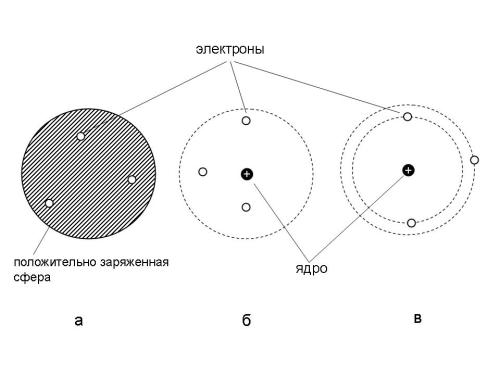
Рис. 2-3 из §2.2. Модели атома: а) Томсона ("сливовый пудинг"), б) Резерфорда ("электронный рой" в пространстве вокруг ядра), в) планетарная модель Бора.
Опыты Резерфорда, о которых подробно рассказано в параграфе 2.2, произвели сильное впечатление на физиков того времени. Но если модель Томсона отвергалась в пользу модели Резерфорда, то возникал неразрешимый вопрос: почему электроны не падают на ядро? Если допустить, что в электронном облаке их удерживает центробежная сила, возникающая при быстром вращении вокруг ядра, то тогда возникает другое затруднение: электрический заряд, движущийся в магнитном поле ядра, неизбежно должен излучать энергию. Если бы атом постоянно излучал энергию, он бы не мог существовать. Классическая физика оказалась бессильной перед этой проблемой.
К счастью, существовало еще одно досадное затруднение классической физики, разрешение которого неожиданно помогло продвинуться в понимании строения атома. Классическая физика не могла объяснить, почему при нагревании физическое тело начинает светиться не синим или фиолетовым, а красным светом. С помощью излучения нагретое физическое тело избавляется от излишка энергии. Но наиболее эффективная, быстрая отдача энергии должна происходить с помощью коротковолновых световых волн, способных нести много энергии! В этом случае нагреваемый в горне кусок железа должен выглядеть фиолетовым или синим, но не красным! Наше Солнце – огромное, нагретое до высоких температур физическое тело, должно заливать Землю фиолетовым (и даже еще более коротковолновым) излучением. Разумеется, это резко противоречит тому, что мы наблюдаем.
Берлинский профессор Макс Планк в течение многих лет занимался этой проблемой. В конце концов он пришел к выводу, что единственный выход – это предположить, что излучение света веществом происходит не непрерывно, а отдельными "элементарными" порциями энергии, которые рождаются колеблющимися атомами. Такие “порции” световой энергии называются квантами энергии.
Непрерывное волновое излучение нагретого тела действительно должно было бы иметь малую (фиолетовую) длину волны, в то время как излучение того же количества энергии как бы "зарядом картечи" из мелких порций энергии должно состоять (чисто статистически) из волн разной энергии, среди которых фиолетовые не обязательно в большинстве.
Можно привести такую аналогию. В некоем городе наступила небывалая жара и все люди на различных видах транспорта устремились за город, на природу. Наиболее быстро все могли бы выехать на легковых машинах, которые развивают наибольшую скорость. Но кто-то едет на автобусе, кто-то на велосипеде, кто-то на электричке. Если построить график в координатах: "число машин" – "скорость машин", то выяснится, что очень быстроходных и очень тихоходных машин довольно мало, а основная масса людей передвигается за город не очень быстро, но и не очень медленно (рис. 2-14а).
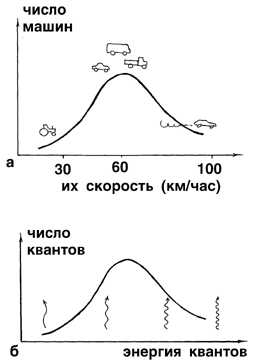
Рис. 2-14. а) График распределения машин в городе по скорости их движения: "лихачей" и "тихоходов" относительно мало, а основная масса водителей соблюдает обычный скоростной режим. б) Аналогичный график для квантов света, рождаемых "быстрыми" и "медленными" атомами по гипотезе Планка.
То же самое можно сказать об энергии, которая покидает нагреваемое тело в виде светового излучения (рис. 2-14б). Поскольку в нагретом теле одинаково мало как "быстрых", так и "медленных" атомов, совершающих колебания, то излучаемый ими при каждом колебании свет содержит мало как коротко-, так и длинноволновых "порций" световой энергии. А основная масса энергии уносится из нагретого тела "порциями" света с электромагнитными волнами какой-то средней длины. Таким образом, тело испускает главным образом не фиолетовый, а, например, желтый свет.
Планк исходил из того, что свет испускается группами колеблющихся атомов (впоследствии оказалось, что это не так, но не помешало сделать правильный вывод о “порциях” световой энергии). Здесь важна идея не только о квантах энергии, но и об атомах – "квантах" материи, без которых невозможно представить образование квантов энергии.
Итак, по мнению Планка, в нагретом веществе группы атомов, колеблющихся с очень высокими (и очень низкими) частотами не могут составлять большинство (как не составляют большинство "лихачи" на дорогах), и основная масса порций энергии выделяется в области каких-то промежуточных, "средних" частот. Поэтому нагретый в горне металл (или раскаленная поверхность Солнца) при высоких температурах светятся белым (в белом есть кванты всех длин волн), но не фиолетовым светом.
Элементарная "порция" энергии ε (эпсилон) связана с частотой электромагнитной световой волны, которая эту энергию несет, простым соотношением ε = hν, где h – некоторая константа, необходимая уже для того, чтобы уравнять размерности энергии Е (джоуль) и частоты ν (1/сек). Вспомните формулу E = kν, полученную в нашем опыте с океанскими волнами на рис. 2-10. Эта элементарная порция волновой энергии получила, как мы уже знаем, название кванта, а константа h называется постоянной Планка.
Сам Планк в 1900 году скромно называл свою гипотезу "математическим приемом" и "рабочим предположением". Он не скрывал, что был вынужден выдвинуть такую "странную" формальную гипотезу ради одного – чтобы любой ценой получился положительный результат. Это было нелегко сделать теоретику-классику, воспитанному на принципе "природа не делает скачков", в докторской диссертации которого за 20 лет до описываемых событий развивалась мысль о том, что атомистические взгляды на строение материи приводят к противоречиям.
В 1912 году на квантовую гипотезу обратил внимание датский физик Нильс Бор, который применил ее к модели атома Резерфорда и получил поразительные результаты в объяснении атомных спектров испускания водорода. Бор предположил, что электронный "рой" в модели Резерфорда не беспорядочен. Электроны в нем располагаются на строго определенных, постоянных орбитах (рис. 2-3в).
В модели Резерфорда электроны тоже двигались по орбитам, но эти орбиты могли быть "спиралевидными". Двигаясь по спирали ближе или дальше к ядру, атом мог излучать или поглощать энергию. В этом случае спектры испускания атомов должны были быть похожими на непрерывный солнечный спектр, а спектр испускания водорода оказался прерывистым, линейчатым (рис. 2-13).
Бор предложил считать аксиомой тот факт, что только на постоянных, стационарных орбитах электрон может существовать устойчиво, не падая на ядро. Объяснение этого феномена Бор откладывал до лучших времен, предлагая посмотреть, как новая модель объясняет экспериментальные факты. Постулаты Бора можно сформулировать следующим образом:
1. В атоме существуют орбиты, находясь на которых электрон не излучает энергию. Эти орбиты называются стационарными.
2. Излучение происходит только при перескоке электрона с одной стационарной орбиты на другую.
Теперь обратимся к экспериментальным фактам. Если сильно разогреть газ, как это происходит в водородной лампе, то атом поглощает часть энергии. При этом электрон скачком переходит с нижней стационарной орбиты (уровня, оболочки – это одно и то же) на более высокие стационарные орбиты (уровни, оболочки). Такой "возбужденный" атом не может долго существовать и электрон возвращается ("падает") на более низкую орбиту, выделяя при этом строго определенную порцию (квант) световой энергии. Поскольку орбит в атоме конечное число, в спектре испускаемого водородной лампой света наблюдаются не плавные переходы от одного цвета к другому, а лишь отдельные линии на черном фоне (рис.2-13) – это и есть линейчатый спектр. Число линий должно совпадать с числом электронных переходов между стационарными орбитами.
Например, переход электрона с более высоких уровней на 2-й уровень сопровождается выделением отдельных "порций" световой энергии – квантов света в видимой области (в основном синих). Переходы между близко расположенными уровнями дают менее энергичные кванты красного цвета. Наиболее энергичные (ультрафиолетовые) кванты выделяются при возврате электрона на ближайший к ядру 1-й уровень. Кванты одного вида сливаются вместе и наблюдаются в спектрометре в виде тонких линий определенного цвета.
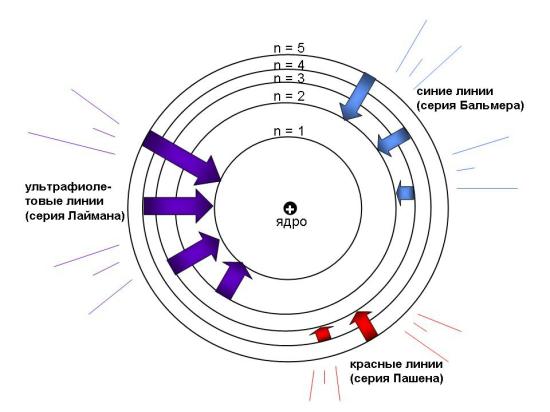
Рис. 2-15. Электронные переходы в атоме водорода: серия Лаймана (самое богатое энергией ультрафиолетовое излучение) возникает в результате переходов с уровней n = 5, 4, 3, 2 в основное состояние (n = 1). Серия Бальмера (видимый свет) возникает при переходах с уровней n = 5, 4, 3 на уровень n = 2. Серия Пашена (красный свет) возникает в результате переходов с уровней n = 6, 5, 4 на уровень n = 3. Серии линий в спектре водорода названы именами открывших их ученых. Происхождение спектральных линий впервые объяснил Н. Бор.
На Солнце кванты света испускаются возбужденными атомами многих элементов, поэтому, как уже говорилось, его спектр кажется нам "непрерывным" (см. рис. 2-11 в начале этого параграфа).
_________________