** § 2.7 Понятие о квантовой теории строения атома. Атомные спектры. Квантовые числа. (продолжение)
В атоме водорода только один электрон и его спектр испускания относительно прост. В спектрах испускания атомов других элементов число линий больше. Еще до появления модели Бора физики научились различать в таких спектрах близко расположенные линии, отличающиеся по внешнему виду. Одни из них (очень узкие) получили название "резких" (от англ. sharp). Наиболее яркие линии назвали "главными" (от англ. principle). Наблюдались более широкие линии - их назвали "размытыми" (diffuse). Еще один сорт линий имеет название "фундаментальных" (от англ. fundamental). По первым буквам английских названий говорили о наличии в спектрах испускания s-, p-, d- и f-линий. Применительно к модели Бора это означает, что в спектрах атомов более сложных, чем водород, постоянные электронные уровни могут состоять из нескольких близко расположенных подуровней:
s-подуровень назван по "резкой" (sharp) линии,
p-подуровень назван по "главной" (principal) линии,
d-подуровень назван по "диффузной", “размытой” (diffuse) линии,
f-подуровень назван по "фундаментальной" (fundamental) линии.
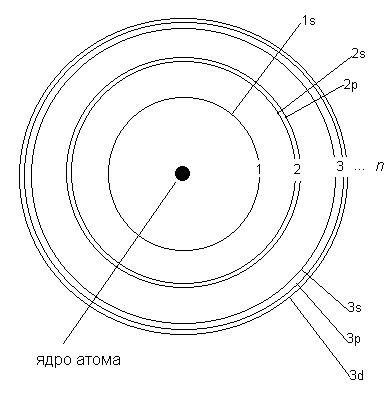
Сложное устройство уровней показано на рис. 2-6, который мы здесь воспроизводим еще раз:

Рис. 2-6. Электронные подуровни атомов более сложных, чем водород. Наличие подуровней объясняет происхождение в спектрах "резких" (sharp), "главных" (principle) и "размытых" (diffuse) линий. Более высокие уровни на рисунке не показаны.
С помощью спектров выяснилось, что первый уровень (n = 1) не содержит каких-либо подуровней, кроме s. Второй уровень состоит из двух подуровней (s и p), 3-й уровень - из трех подуровней (s, p, и d) и т.д. Как мы видим, подуровни обозначаются по первым буквам английских названий соответствующих линий в спектрах. В дальнейшем более высокие подуровни стали обозначать, просто продолжая латинский алфавит: g-подуровень, h-подуровень и т.д.
На рис. 2-16 показана диаграмма части энергетических переходов электронов в атоме лития, полученная из спектра испускания раскаленных паров этого металла.
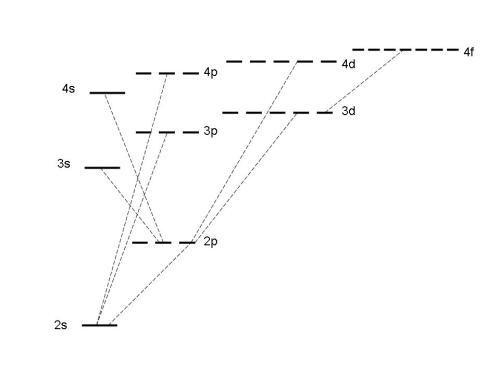
Рис. 2-16. Диаграмма части энергетических уровней и подуровней атома лития. Уровень 1s находится намного ниже уровня 2s и не поместился в масштаб изображения (рисунок из книги Дж. Кемпбела "Современная общая химия", М.: Мир, 1975, т. 1, с. 109).
Можно заметить, что на рис. 2-16 некоторые подуровни изображены состоящими из нескольких одинаковых по энергии "полочек". Например, p-подуровни состоят из трех одинаковых по энергии частей, d-подуровни - из пяти, f-подуровни - из семи. Откуда это стало известно? Еще в 1896 году немецкий физик П. Зееман поместил в сильное магнитное поле устройство, аналогичное водородной лампе, но наполненное парами раскаленного натрия. Обнаружилось, что в магнитном поле число линий в спектрах испускания возрастает (эффект Зеемана). Аналогичное явление наблюдается и в сильном электрическом поле. Пока на электроны действуют только внутренние силы ядра, часть из них может находиться в состоянии с одинаковой энергией. Но когда появляется дополнительное, внешнее поле, эта энергия уже не может оставаться одинаковой. Анализ спектров Зеемана значительно позже привел физика-теоретика Вольфганга Паули к мысли о том, что на одной энергетической "полочке" может помещаться не больше двух электронов. А чтобы противостоять мощным силам отталкивания, такие электроны должны обладать разным спином (к этому свойству мы вернемся чуть позже). Получается, что в атоме не может быть двух электронов в одинаковом состоянии. Этот вывод известен как принцип (или запрет) Паули.
Физические эксперименты позволяют определить заселенность электронами уровней и подуровней. Для этого надо измерять энергию ионизации атомов, т.е. энергию отрыва от него электронов. Сначала измерить энергию, необходимую для удаления из атома первого электрона, затем 2-го, 3-го и т.д. Оказалось, что во всех атомах есть электроны, для которых энергии ионизации близки. Например, для аргона (в его электронной оболочке 18 электронов) обнаруживаются пять таких групп с близкими энергиями ионизации. В них 2, 2, 6, 2 и 6 электронов. Но 5 самых нижних энергетических уровней атома соответствуют подуровням 1s, 2s, 2p, 3s и 3p (это известно из спектров испускания). В таком случае s-подуровень должен состоять только из одной орбитали (на ней 2 электрона), p-подуровень - из трех орбиталей (там 6 электронов - по два на каждую орбиталь). Можно показать, что d-подуровень в обычных условиях (без внешнего поля) состоит из пяти орбиталей с одинаковой энергией, а f-подуровень - из семи.
Модель Бора постепенно уточнялась. Ученых она привлекала тем, что с её помощью можно было делать довольно точные расчеты. Например, можно было вычислить энергию атома водорода в основном и возбужденном состояниях, определить его радиус, вычислить энергию ионизации и т.д. Для этих целей модель была снабжена ясным и понятным для многих исследователей математическим аппаратом, который разработали в основном сам Н. Бор и его последователь А. Зоммерфельд. Для проведения расчетов требовалось описывать состояние электрона в атоме, т.е. указывать его точный "адрес" в электронной оболочке (точнее - в модели электронной оболочки) с помощью так называемых квантовых чисел. Мы уже знаем, что каждый электрон существует на каком-либо уровне (1, 2, 3, и т.д.). Этот уровень обозначается числом n, которое получило название главного квантового числа. Понятно, что число n может принимать только целые значения.
Поскольку уровням уже присвоено главное квантовое число n, для подуровней было введено вспомогательное квантовое число l. Если главное квантовое число n - это “адрес” уровня, то число l - “адрес” подуровня:
l = 0 – это s-подуровень,
l = 1 – это p-подуровень,
l = 2 – это d-подуровень,
l = 3 – это f-подуровень,
Давайте попробуем разобраться, почему были выбраны именно такие, а не иные значения l для разных подуровней. Для этого посмотрим на уже знакомую нам орбитальную диаграмму на рис. 2-17.
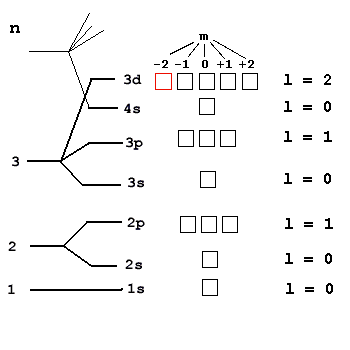
Рис. 2-17. Квантовые числа n, l, m для описания электронных оболочек атомов.
Значения l тесно связаны с числом орбиталей на каждом подуровне. Например, в значении l = 2 “скрыты” пять орбиталей d-подуровня: -2, -1, 0, +1, +2. Значение l = 1 дает три орбитали p-подуровня: -1, 0, +1. А при l = 0 орбиталь на s-подуровне только одна. Нетрудно вычислить, что в значении l = 3 “зашифрованы” семь орбиталей f-подуровня: -3, -2, -1, 0, +1, +2, +3.
Далее требовалось обозначить "адреса" орбиталей на каждом подуровне. Поскольку орбитали атома становятся "видны" только в магнитном поле, очередное квантовое число, записывающее “адрес” орбитали в атоме, назвали магнитным квантовым числом m. Это квантовое число принимает значения от -l до +l, то есть имеет ровно столько значений, сколько орбиталей существует на каждом подуровне.
Давайте с помощью уже известных нам трех квантовых чисел n, l и m запишем “адрес”, орбитали, которая на рис. 2-17 выделена красным цветом. Потом мы сможем этим же способом записывать “адреса” любых других орбиталей и находящихся на них электронов.
Выделенная орбиталь находится на 3-м уровне: следовательно, ее главное квантовое число n = 3. Эта орбиталь находится на d-подуровне: следовательно, ее вспомогательное квантовое число l = 2. Наконец, для этой орбитали магнитное квантовое число m = -2. Итак, “адрес” выделенной орбитали: n = 3, l = 2, m = -2.
Последнее квантовое число, которое потребовалось для описания электрона в атоме, называется спиновым квантовым числом s. Спин (по английски - веретено), можно представить как вращение заряда электрона вокруг собственной оси - по часовой стрелке и против часовой стрелки. Спиновое квантовое число может принимать, следовательно, только два значения и в квантовой механике они приняты такими: s = +1/2 и s = -1/2. В современной волновой модели строения атома (о ней - в конце этого параграфа) уже затруднительно рассматривать электрон как вращающуюся частицу конечных размеров. Следует признать, что прежняя трактовка спина в значительной мере утратила смысл. Спин связан с движением заряда внутри самого электрона и не зависит от перемещения электрона в трехмерном пространстве. Здесь нам важно понимать, что существует некое фундаментальное различие между электронами (спин электрона), которое позволяет им существовать на одной орбитали в состоянии с одинаковой энергией, несмотря на сильнейшее отталкивание одноименных зарядов этих электронов.
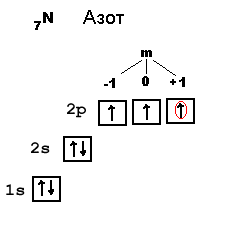 В качестве примера давайте запишем полный набор квантовых чисел для электрона, обведенного красным кружком в орбитальной диаграмме атома азота. Этот электрон характеризуется набором квантовых чисел: n = 2 (находится на 2-м уровне), l = 1(находится на p-подуровне), m = +1 (находится на последней из трех одинаковых p-орбиталей, s = +1/2 (этот электрон заселился первым на данную p-орбиталь).
В качестве примера давайте запишем полный набор квантовых чисел для электрона, обведенного красным кружком в орбитальной диаграмме атома азота. Этот электрон характеризуется набором квантовых чисел: n = 2 (находится на 2-м уровне), l = 1(находится на p-подуровне), m = +1 (находится на последней из трех одинаковых p-орбиталей, s = +1/2 (этот электрон заселился первым на данную p-орбиталь).
Заметим, что это справедливо для атома, в котором первым занял место в электронной оболочке на 1s-подуровне электрон со спином +1/2. Но таких атомов в природе ровно половина, а другая половина начинает заселение своей оболочки электроном со спином -1/2. Для простоты дальше мы будем рассматривать только те 50% атомов любых элементов, где самым первым в оболочку попал электрон с s = +1/2.
Можно решать и обратную задачу. Допустим, последним электронную оболочку некоего элемента заселяет электрон с набором квантовых чисел:
n = 3, l = 2, m = -2, s = +1/2.
Какой это элемент? Какова его полная электронная формула? Решение заключается в том, что данный электрон находится на 3-м уровне (n = 3), причем на d-подуровне (l = 2). Полезно нарисовать все пять d-орбиталей и расположить над ними значения магнитного квантового числа m от -2 до +2. У нас это уже сделано на рис. 2-17, причем нужная орбиталь (m = -2) выделена красным цветом. Расположив на ней единственный электрон (стрелка вверх, т.к. s = +1/2) и зная, что он последний, мы приходим к выводу, что остальные d-орбитали пусты. Теперь мы уже можем записать сокращенную электронную формулу элемента: …3d1. Этот элемент легко найти в периодической таблице - это скандий 21Sc. Если вы еще не совсем уверенно обращаетесь с Периодической таблицей, то можно заполнить электронами на рис. 2-17 все нижние уровни и подуровни вплоть до первой 3d-орбитали, поместив на нее единственный d-электрон. Всего на орбитальной диаграмме элемента поместится ровно 21 электрон (проверьте!), следовательно, в его ядре 21 протон и его порядковый номер в таблице Менделеева тоже 21 (Sc). Орбитальная диаграмма помогает записать и полную электронную формулу для скандия: 1s2 2s2 2p6 3s2 3p6 4s2 3d1.
Как мы видим, каждый электрон в атоме имеет свой собственный “адрес”, записанный набором из четырех квантовых чисел. Например, если два электрона находятся на одном и том же уровне (имеют одинаковое число n), и даже на одном подуровне (например, p-подуровне), то они обязательно расположатся на разных орбиталях - то есть будут отличаться числом m. А если орбитали уже полностью заполнены, то два находящиеся на них электрона обязательно должны отличаться друг от друга спиновым квантовым числом s. Таким образом, теперь мы можем дать более строгую формулировку принципа или запрета Паули:
Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел n, l, m, s.
Внимательный читатель мог заметить, что на рисунке 2-16, показывающем электронные переходы в атоме лития, порядок заполнения уровней и подуровней вполне логичный: 1s, 2s, 2p, 3s, 3p, 3d, 4s … . Как показали спектры испускания, это характерно только для атомов c небольшим числом электронов. Впрочем, об этом редко вспоминают, потому что у самых легких элементов на 3-м и 4-м уровнях вообще нет электронов. С увеличением числа электронов в атоме подуровень 4s, как мы уже знаем, начинает заполняться раньше, чем 3d. А на более высоких уровнях такие "нарушения" становятся правилом. Можно воспользоваться уже освоенными нами квантовыми числами для того, чтобы уметь воспроизводить ряд заполнения электронами уровней и подуровней большинства атомов (1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d …) с помощью правила Клечковского:
Энергия уровней и подуровней возрастает в порядке увеличения суммы n + l, а при одном и том же значении этой суммы ниже располагаются уровни с меньшим n.
Но на практике гораздо легче не мучиться со сложением квантовых чисел, а использовать для реконструкции этого ряда схему длинной формы Периодической таблицы, с которой мы познакомимся в главе 4.
В модели Бора электрон рассматривался как частица. Его положение в пространстве, орбита и скорость описывались теми же методами, которые используются при вычислении траекторий планет. Но для космических тел не бывает "разрешенных" и "неразрешенных" орбит, а в атоме Бора могли быть только разрешенные (стационарные) орбиты. Находясь на этих орбитах, электрон почему-то не излучает энергию при движении вокруг заряженного ядра. Эта устойчивость электрона на стационарных орбитах так и оставалась необъяснимой.
В 20-х годах прошлого века французский физик Л. де Бройль выдвинул гипотезу о том, что электрон обладает свойствами не только частицы, но и волны. Впоследствии это удалось подтвердить экспериментально. Гипотеза де Бройля позволила изящно объяснить, почему электрон в атоме может существовать только на стационарных орбитах. Стационарными орбитами в атоме могут быть только такие орбиты, в которые укладывается целое число длин волн электрона. Такая волна называется "стоячей" (рис. 2-18).
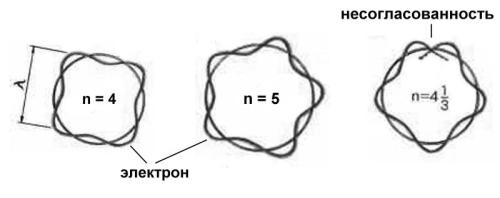
Рис. 2-18. Разрешенные и неразрешенные стоячие волны электрона на боровских орбитах. Стоячие волны на круговой орбите могут существовать только при условии, что длина орбиты равна целому числу длин волн (два первых рисунка). На последнем рисунке это условие не соблюдается и волна гасит сама себя. Такая модель наглядно показывает, что квантовое число n может быть только целым.
Появление гипотезы де Бройля открыло принципиальную возможность описывать электрон в атоме уже не как частицу, а как волну. Это в 1926 году сделал австрийский физик Э. Шредингер. Он применил к электрону в атоме математический аппарат, описывающий движение волны в трехмерном пространстве. Такое движение описывается математической функцией (её называют "пси"-функцией), в которую входят координаты трехмерного пространства x, y, z. Оказалось, что квадрат этой функции описывает уже не движение волны, а вероятность обнаружить эту волну в точке пространства с координатами x, y, z. Так появилась возможность рассчитывать вероятность нахождения электрона-волны в разных точках пространства вокруг ядра.
Результаты решения уравнения Шредингера для атома водорода обычно приводятся в виде уже знакомых нам "электронных облаков": это сферические s-облака (s-орбитали), гантелеобразные p-облака (p-орбитали) и т.д.
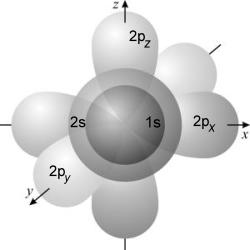
Рис. 2-19. Орбитали атомов элементов, заполняющих свою внешнюю электронную оболочку на 2-м уровне. У таких атомов, как N, O, F и Ne электроны присутствуют на каждой из изображенных орбиталей.
На рисунке 2-19 изображена волновая модель электронной оболочки таких атомов, как, например, бор, углерод, азот, кислород, фтор, неон. Мы видим, что p-орбитали и s-орбитали в этой модели "пронизывают" друг друга. Но разве могут области существования разных электронов пересекаться? Как может, например, p-электрон существовать "внутри" s-электрона? И могут ли 1s-электроны находиться "внутри" 2s-электронов? Объяснение заключается в том, что до сих пор не удается решить уравнение Шредингера для атомов с двумя и более электронами, поэтому мы вынуждены пользоваться результатами расчетов для одноэлектронных атомов - атома водорода, ионов He+, Li2+, С5+ и т.д. В этих системах электрон находится либо на s-орбитали, либо на p-орбиталях и никогда не встречается ситуация с одновременным нахождением нескольких электронов на разных орбиталях. Таким образом, для описания многоэлектронных атомов приходится применять одноэлектронное приближение волновой модели, не учитывающее взаимное влияние электронов. Это вынужденный и одновременно смелый шаг. Впрочем, он оказался оправданным - модель хорошо "работает" не только при описании свойств многоэлектронных атомов, но и в теории химической связи. Именно такое представление атомных орбиталей весьма пригодится вам при изучении органической химии - для описания электронного строения органических соединений и объяснения их химических свойств.
Но можно ли считать электрон исключительно волной? Разумеется, нет. Термин "корпускулярно-волновой дуализм" предполагает обязательное наличие у объекта (электрона) как свойств частицы, так и свойств волны. Интересно об этом рассуждали крупнейшие физики, стоявшие у истоков квантовой механики. Вот, например, выдержка из воспоминаний нобелевского лауреата В. Гейзенберга: «…Электрон всегда рисовался моему воображению в виде маленькой сферы. Я бывало говорил только одно: «Иногда, конечно, можно с пользой назвать его волной, но это не более чем способ разговора, а физическая реальность тут ни при чем». Характерно мнение другого замечательного физика - А. Зоммерфельда, высказанное в лекции «Современное состояние атомной физики» в Гамбургском университете в феврале 1927 года: «…В трехмерном пространстве электрон нельзя локализовать. Это подчеркивает Гейзенберг, а Шредингер иллюстрирует это, «размазывая» заряд электрона в сплошную пространственную массу. Лично я не верю в этот размазанный, растекающийся электрон уже потому, что вне атома электроны-корпускулы, обладающие большой скоростью, с несомненностью могут быть установлены экспериментом. С другой стороны, неоспоримый факт, что сплошные плотности Шредингера при расчете физических и химических действий атома оказывают неоценимую помощь и в этом смысле реальны в большей степени, нежели точечно локализованный электрон старой теории».
Нам необходимо понимать, что изображения орбиталей волновой модели - это не внешний вид электронов в атоме, а области вероятности найти s-, p- или какой-либо другой электрон в пространстве вокруг ядра. Для того, чтобы такие области имели не слишком размытые границы, на рисунках показывают области с 95%-ной вероятностью обнаружить здесь электрон. Надо также помнить, что это области вероятности, рассчитанные в рамках данной модели атома. Поэтому, когда вы читаете в учебнике, что вспомогательное (оно же орбитальное, побочное, азимутальное) квантовое число l определяет форму электронного облака, то должны при этом понимать, что такое облако - не более чем абстрактное математическое построение в рамках волновой модели атома. Например, сейчас уже мало кто вспоминает, что в модели Бора-Зоммерфельда квантовое число l "заставляло" s-электроны двигаться по наиболее вытянутым, эллиптическим орбитам, в то время как орбиты p- и d-электронов оказывались близкими к круговым.
Модель Бора-Зоммерфельда очень красива и до сих пор используется художниками для создания символики, отражающей достижения современной физической науки. Ниже вы видите несколько таких примеров: герб города Дубна (здесь расположен один из крупнейших российских исследовательских центров), эмблема физического факультета Новосибирского университета, ледокол "Россия" с изображением электронной оболочки атома гелия в рамках "устаревшей" модели Бора-Зоммерфельда. Интересно, знал ли эту подробность художник, создававший эмблему? Для моряков встречных судов такой рисунок на борту ледокола означает лишь, что этот могучий корабль оснащен атомной силовой установкой.



Следует все же помнить, что термин "орбита" (из модели Бора) в волновой модели теперь полностью уступил место термину "орбиталь". Орбиталь имеет чисто вероятностный смысл и её просят не путать с орбитой, т.е. траекторией движения электрона.
В этом параграфе были упомянуты три важных составляющих современной электронной модели атома: принцип минимума энергии, правило Гунда, запрет Паули. Вместе с четырьмя квантовыми числами они позволят описывать электронную оболочку атома элемента, исходя лишь из порядкового номера этого элемента в таблице Менделеева.
Не следует относиться к построениям квантовой теории, как к окончательной, не подлежащей сомнению истине. Квантовая теория - это лишь модель такого сложного природного явления, каким является атом. Квантовая модель удобна тем, что позволяет предсказывать многие, даже еще не открытые свойства различных элементов. В этом ее преимущество перед многими предшествующими теориями строения материи.
В последующих главах мы будем пользоваться современной электронной моделью атома для объяснения таких сложных явлений, как возникновение химической связи, образование молекул, их пространственная форма, существование ионов и т.д. Мы также сможем предсказывать многие химические свойства элементов и их соединений. Наконец, мы объясним Периодический закон Д.И.Менделеева и увидим, насколько гармонично он сочетается с современной моделью атома, хотя был сформулирован в то время, когда Планк, Резерфорд и Бор еще не начинали свою работу.
_________________