** §4.4. f-Элементы. Открытие новых элементов. Ядерные реакции.
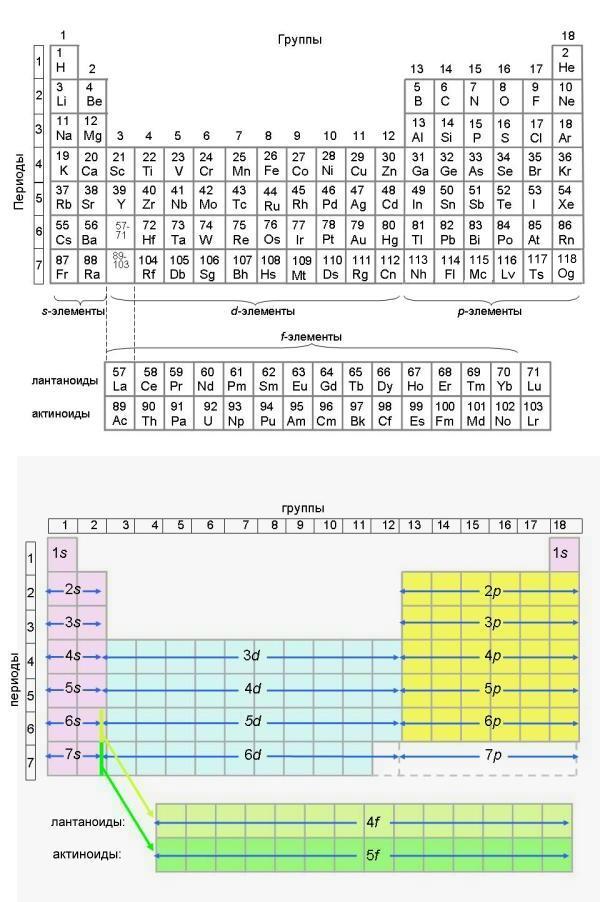
С увеличением атомного номера в Периодической таблице неизбежно наступает момент, когда у элементов начинают заполняться f-подуровни. Это происходит после заполнения 6s-подуровня - сразу после элемента 56Ba с валентной оболочкой ...6s2.
Поскольку при заполнении семи f-орбиталей образуется целых 14 f-элементов, разместить их в восьми группах короткой формы Периодической таблицы было бы весьма проблематично - для этого пришлось бы создавать еще дополнительные побочные подгруппы. Пользоваться такой таблицей было бы крайне неудобно. В длинной форме, где побочных подгрупп не бывает, такой проблемы нет. Однако добавление еще одного блока из четырнадцати f-элементов сильно вытягивает таблицу и делает ее "сверхдлинной" (такая таблица тоже есть, о ней мы расскажем ниже). Печатание "длинных" таблиц в книгах вызывает чисто технические проблемы. Поэтому как в короткой, так и в длинной формах Периодической таблицы обычно обозначают место, с которого начинаются f-элементы, а сами эти элементы выносят в отдельные строчки. В нижней части любой таблицы мы видим одну строчку из f-элементов “лантаноидов” (по имени элемента лантана La, открывающего ряд f-элементов) и строчку из f-элементов “актиноидов” (по имени элемента актиния Ac). У лантаноидов постепенно заполняются 4f-орбитали, у актиноидов – 5f-орбитали. Клеточки с f-элементами в Периодической таблице обычно окрашены в зеленый цвет.
Еще раз проиллюстрируем здесь структуру длинной формы Периодической таблицы:

Итак, f-элементами являются 14 лантаноидов и 14 актиноидов. Здесь мы вступаем в область довольно сложных, хотя и очень интересных деталей Периодического закона, поэтому при чтении этого параграфа вам следует при необходимости заглядывать в Приложение, где находятся таблицы электронных конфигураций элементов.
Найдем в Периодической таблице клеточку, которую занимает элемент ...6s2 (56Ba) и сразу за которой мы должны встретиться с первым f-элементом. Элемент лантан (57La) иногда помещают сразу за барием - в клеточку, с которой должны начинаться 5d-элементы. Эта клеточка по праву должна принадлежать d-элементу лютецию (Lu). Поэтому во многих изданиях таблицы в этой “спорной” клеточке стоит обозначение “La-Lu”. Это означает, что в данном месте Периодической системы элементов существует целая серия из 14-и f-элементов, которые просто для удобства помещены в отдельной строчке внизу таблицы.
Наверное, для того, чтобы озадачить химиков и заставить их спорить о правильности того или иного варианта Периодической таблицы, Природа сделала так, что 4f1-элемент во Вселенной не существует! Пожалуйста - есть 4f2-элемент церий (58Ce), но нет 4f1-элемента! Им должен был быть лантан, следующий сразу за барием. Но у лантана происходит “проскок” электрона (об этом явлении мы уже знаем из второй главы) и его 4f1-электрон оказывается на подуровне 5d1. Может возникнуть вопрос - а чем отличается от лантана элемент лютеций, у которого тоже есть электрон 5d1? На самом деле, конечно, у этих элементов разные электронные оболочки: у лантана внешняя оболочка ...6s24f0 5d1, а у лютеция весь 4f-подуровень уже заполнен: ...6s2 4f14 5d1. Те издания короткой (из 8 групп), и длинной формы таблицы, где в 57-й клеточке нарисован только лантан (La) не содержат никакой ошибки. Ведь и в самом деле лантан является d-элементом!
Можно долго спорить о том, в какую клеточку Периодической таблицы лучше помещать лантан, надо ли его относить к f- или d-элементом, правильно ли помещать d-элемент лютеций (71Lu) среди лантаноидов? На самом деле ответ (пусть шутливый, но вполне обоснованный) может быть таким: лантан был задуман Природой как первый f-элемент, поэтому его место - среди f-элементов лантаноидов, несмотря на “проскок” электрона. Поскольку в природе есть "полноправный" (а не "случайный", как La) 5d1-элемент лютеций - место в группе под 4d1-элементом иттрием должен занимать именно лютеций 71Lu. Кстати, на химических свойствах лантана в сравнении с другими лантаноидами "проскок" электрона практически никак не сказывается.
Но окончательно всё на свои места (в прямом смысле) расставляет сверхдлинная форма Периодической таблицы. В ней для f-элементов просто предусмотрен отдельный блок, а лютеций (Lu) и лоуренсий (Lr) сразу попадают на свои места в блоке d-элементов.
Сверхдлинная Периодическая таблица
Примечание. В сверхдлинной форме Периодической таблицы, как и в длинной, 18 групп: все лантаноиды и актиноиды включены в 3 группу.
У лантаноидов заполняются "глубинные" 4f-орбитали третьего снаружи уровня. На внешнем 6s-подуровне все они имеют по 2 электрона (...6s2) и обладают очень похожими химическими свойствами. Лантаноиды – активные металлы, все они реагируют с водой с образованием элементарного водорода и гидроксида металла. Их преимущественная степень окисления +3.
Из-за похожести химических свойств многие лантаноиды долго не удавалось выделить в чистом виде. Кроме того, в природных минералах они встречаются редко и в небольших количествах. Отсюда еще одно общее название лантаноидов - редкоземельные элементы.
Актиноиды меньше похожи друг на друга по своим химическим свойствам. Их исследование очень затруднено из-за неустойчивости атомов этих элементов (претерпевают радиоактивный распад). Кстати, у первого члена ряда актиноидов - элемента актиния (89Ac) тоже наблюдается “проскок” 5f1-электрона на 6d1! Это, как мы уже знаем, связано с требованием минимизации энергии атома данного элемента, но никак не меняет общих закономерностей Периодической таблицы.
Заполнение 5f-оболочек у актиноидов заканчивается на элементе 102 (No, нобелий). Здесь в Периодической таблице расположены элементы с уже очень "тяжелыми" и поэтому неустойчивыми ядрами.
Последний из “тяжелых” элементов, еще существующих в природе - это уран (
92U). Уран радиоактивен, то есть постепенно распадается с образованием ядер других элементов. Однако скорость этого распада все же не так велика, чтобы весь уран на Земле успел исчезнуть. Все элементы с более тяжелыми ядрами давно распались и сегодня в минералах их найти невозможно. Такие элементы получают только искусственным путем - синтезом их атомов из ядер более легких элементов с помощью ядерных реакций.Сначала атомы одного из исходных элементов превращают в ионы - чтобы они приобрели заряд и могли быть разогнаны до высоких скоростей на специальных сложных приборах - ускорителях. Затем разогнанными на ускорителе ядрами бомбардируют мишень из атомов другого элемента. При высоких энергиях ионных пучков на таких ионных ускорителях удается добиться слияния двух ядер в новое ядро с зарядом, равным сумме зарядов двух ядер.
Открытие новых элементов сегодня - чрезвычайно сложный и долгий процесс. Во-первых, больших усилий требует получение чистого материала мишеней (часто это редкие изотопы уже известных элементов). Накопленный в специальном ядерном реакторе изотоп необходимо выделить и тщательно очистить – это сложная задача для радиохимиков. Во-вторых, атомы синтезированных искусственных элементов живут очень недолго – порядка секунд для элементов с Z = 101-103, а при дальнейшем увеличении массы ядер время жизни атомов катастрофически уменьшается Иногда в экспериментах удается зафиксировать и распознать лишь одно-два ядра нового элемента.
Немногие страны обладают научным и технологическим потенциалом, позволяющим проводить столь сложные исследования. Начиная с середины прошлого века, в открытии новых элементов соревновались в основном два исследовательских центра – Объединенный институт ядерных исследований (ОИЯИ) в Дубне (Россия) и Ливерморская национальная лаборатория в Беркли (США). Впоследствии к ним присоединились лаборатории в Лундте и Дармштадте (Германия), а также Институт физико-химических исследований RIKEN (Япония).
В качестве примера расскажем о работах по синтезу 110-го элемента, который получил название "дармштадтий" (происхождение названия, конечно, понятно – он был впервые получен в немецкой лаборатории). Для синтеза ядер этого элемента в лаборатории Дармштадта на мощном ионном ускорителе мишень из свинца-208 (изотопа свинца 82Pb с массовым числом A = (Z + N) = 208) облучалась ядрами никеля-62 (изотопа никеля 28Ni с массовым числом 62). Это приводило к образованию ядер 110-го элемента с числом протонов (82 + 28) = 110 и с числом нейтронов – 159 (т.е. изотопа 269110Ds). Схематично ядерную реакцию, использованную в Дармштадте, можно записать так::
20882Pb + 6228Ni → 269110Ds + 0n (нейтрон)
В Дубне для синтеза 110-го элемента использовали мишень из плутония-244, которая облучалась ядрами серы-34. Этот эксперимент проводился на дубнинском ускорителе совместно с Ливерморской лабораторией (США), которая изготовила для эксперимента плутониевую мишень высокого качества. Было зарегистрировано несколько атомов 110-го элемента с числом нейтронов 163. Ядерная реакция в этом случае выглядит так:
24494Pu + 3416S → 273110Ds + 5 0n.
Впоследствии выяснилось, что из короткоживущих изотопов дармштадтия дольше всех "живет" изотоп с массовым числом 271 - именно это значение приведено в клеточке элемента в современной Периодической таблице.
Новый элемент не считается открытым до тех пор, пока одна группа исследователей не получит надежных результатов по исследованию его атомов и пока другая (независимая) группа ученых не подтвердит эти результаты. Поэтому дальние клеточки Периодической таблицы заполняются медленно.
Есть и другая проблема - как называть вновь открытые элементы? По традиции исследователи, впервые получившие новый элемент, могут предлагать его название, однако иногда возникали долгие споры.
Дело в том, что Периодический закон и Периодическая система Д. И. Менделеева являются общемировым достоянием и названия новых элементов, остающиеся в них навечно, могут закрепиться лишь при единодушном согласии ученых всего мира. В тех случаях, когда открытие нового элемента еще не подтверждено, либо название не утвердилось окончательно, используются “временные” названия, связанные с атомным номером элемента. Например, элемент 104 был получен советскими физиками в 1964 году и получил название “курчатовий”
(Ku) в честь русского физика И. В. Курчатова. В 1969 году этот же элемент воспроизвели в своих опытах американские исследователи и предложили для него название “резерфордий” (Rf) в честь английского физика Э. Резерфорда. До тех пор, пока вопрос о названии 104-го элемента не был решен окончательно, во многих изданиях Периодической таблицы он назывался “унилквандий” и обозначался символом Unq. Здесь “ун” означает 1, “нил” – 0 и “квад” – 4. Точно так же элемент 105 назывался “унилпентий” (Unp), элемент 106 – “унилгексий” (Unh) и так далее.В 1987 году Международные союзы чистой и прикладной химии (IUPAC) и физики (IUPAP) создали совместную международную комиссию, которая рассмотрела вопрос о приоритете в открытии новых элементов и сделала предложения относительно их наименований. А в январе 1997 г. специальный комитет IUPAC обнародовал решение по названиям элементов № 104–109. Позже состоялись аналогичные решения по другим вновь открытым элементам. Вероятно, эти названия уже сохраняться окончательно в Периодической таблице:
- элемент 104 назван резерфордием (Rf) - в честь английского физика Эрнста Резерфорда, внесшего огромный вклад в установление строения атома;
- элемент 105 назван дубнием (Db) - в честь города в России, где был открыт этот и многие другие новые элементы.
- элемент 106 назван сиборгием (Sg) - в честь американского физика и радиохимика Гленна Сиборга, участвовавшего в выделении и синтезе многих новых элементов - плутония, нептуния, кюрия, америция, берклия, калифорния, эйнштейния, фермия, менделевия; сделавшего множество других важнейших работ по физике и химии тяжелых элементов;
- элемент 107 назван борием
(Bh) - в честь знаменитого датского физика Нильса Бора. Кстати, неправы те, кто думает, что в честь Нильса Бора уже назван элемент бор. Этот элемент был открыт и назван химиками Гей-Люссаком и Тенаром еще в 1808 году;- элемент 108 назван хассием (Hs) - в честь земли Гессен в Германии, где находится крупнейший научно-исследовательский центр по синтезу и изучению новых элементов;
- элемент 109 назван майтнерием (Mt) - в честь австрийской исследовательницы (физика и радиохимика) Лизе Майтнер, которая вместе с О. Ганом открыла элемент протактиний и сделала много других важнейших работ, способствовавших установлению строения атома. В российских школьных (и не только школьных) учебниках элемент 109 почему-то упорно называют "мейтнерием", хотя это неправильно - буквосочетание "ei" в фамилии Meitner (и вообще в немецком языке) читается как "ай".
- элемент 110 назван дармштадтием (Ds) - в честь города Дармштадта в Германии, где открыты многие новые искусственные элементы.
- элемент 111 назван рентгением (Rg) - в честь немецкого физика Вильгельма Конрада Рентгена. Открытое им в 1895 году проникающее излучение, называемое теперь рентгеновским, играет огромную роль в химии при изучении строения вещества.
- элемент 112 получил название коперниций (copernicium - Cn) - в честь знаменитого польского астронома Николая Коперника. Решение IUPAC об этом состоялось 19 февраля 2010 г. - в день рождения Коперника (1473). Назвать в его честь 112-й элемент предложил один из авторов открытия - руководитель исследовательской группы физиков в Дармштадте Сигурд Хофманн - чтобы “...отдать должное великому ученому, который не получил никаких почестей при жизни и выдвигал на первый план связь между астрономией и ядерной химией.” Такой аргумент, на первый взгляд, может показаться удивительным - ведь о ядерной химии в XV и XVI веке не имели никакого представления! Однако журнал Chemistry International (Vol. 32 No. 2, March-April 2010) публикует изящное объяснение такому решению. Действительно, идеи Коперника оказали исключительное влияние на философские и политические взгляды и привели к появлению современной науки, основанной на экспериментальных результатах. Коперниковская модель Солнечной системы потребовала коренного пересмотра представлений о мире. Планетарная система, введенная Коперником, была применена к другим аналогичным системам, в которых объекты перемещаются под влиянием силы, направленной к общему центру. В микроскопическом масштабе это - Боровская модель атома с его ядром и орбитальными электронами.
Продолжились работы по синтезу еще более тяжелых элементов, которые, по предсказаниям теоретиков, могли оказаться стабильнее, чем их более “легкие” предшественники. Эти предсказания (существование так называемого "островка стабильности" среди сверхтяжелых элементов) постепенно находят подтверждение.
В мае 2012 года IUPAC утвердил еще два новых названия – это элемент 114 флеровий (Fl), названный в честь советского физика-ядерщика Г. Н. Флерова (1913-1990), под руководством которого в ОИЯИ были синтезированы элементы 102-110, и элемент 116 ливерморий (Lv), названный в честь Ливерморской национальной лаборатории в США.
Открытые примерно в то же время элементы 113, 115, 117 и 118 получили свои имена позже – 8 июня 2016 года IUPAC официально рекомендовал принять следующие названия новых элементов:
- элемент 113 назван нихонием (Nt). Впервые он был получен почти одновременно в ОИЯИ и Ливерморской лаборатории. Совместные результаты российских и американских физиков были опубликованы в 2003 году, однако IUPAC не счел их достаточно убедительными. Когда в 2004 году этот элемент синтезировали японские исследователи из института RIKEN, приоритет был отдан им. Самоназвание Японии – Нихон, что в переводе – Страна восходящего солнца.
– элемент 115 назван московием (Mc). Он открыт в России и получил имя в честь Московской области, где в городе Дубна находится ОИЯИ.
– элемент 117 назван теннессином (Тc). Он синтезирован в США и получил название в честь американского штата Теннеси
– элемент 118 оганесон (Og) получен в ОИЯИ. Назван в честь академика Ю. Ц. Оганесяна, руководителя Лаборатории ядерных реакций. Это свидетельство высоких заслуг нашего соотечественника перед мировой наукой – до этого только еще один элемент был назван в честь действующего ученого (сиборгий, см. выше). Название оганесон (а не оганесий, как можно было ожидать согласно традиции) было выбрано в связи с тем, что в Периодической таблице 118-й элемент находится в группе инертных газов. А названия этих благородных элементов, за исключением гелия, заканчиваются на "он" – неон, аргон, криптон и т.д.
Еще предстоит большая работа по синтезу наиболее устойчивых изотопов недавно открытых элементов – это важно для поиска упомянутого выше "островка стабильности". Так, период полураспада наиболее стабильного изотопа нихония Nh-286 составляет 20 секунд, и среди других сверхтяжелых элементов он –настоящий "долгожитель". Приведенные здесь сведения о времени жизни, как и названия новых элементов на русском языке, опубликованы в журнале "Наука и жизнь", № 1 за 2017 г.
Задачи.
4.8. В 1963 г в Дубне группа академика Г.Н.Флерова открыла новый элемент при помощи ядерной реакции:
23892U + 2210Ne → 256?X + 4 нейтрона.
Какой элемент был открыт?
4.9. Элемент 104 впервые получен в СССР группой академика Г.Н.Флерова при бомбардировке на ускорителе мишени из плутония ионами некоего элемента. Какой элемент использовался в виде ионов? Несмотря на неустойчивость элемента 104 (период полураспада его самого долгоживущего изотопа 70 секунд) удалось получить и описать хлорид этого элемента. Химики действовали не в слепую - формулу хлорида они могли вычислить заранее. Какова формула хлорида элемента 104?
_________________