Группы элементов |
Пери-
оды |
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
| 1 |
1
водород
H
1,0079 |
|
|
|
|
|
|
2
гелий
He
4,0026 |
| 2 |
3
литий
Li
6,941 |
4
бериллий
Be
9,01218 |
5
бор
B
10,81 |
6
углерод
C
12,011 |
7
азот
N
14,0067 |
8
кислород
O
15,9994 |
9
фтор
F
18,9984 |
10
неон
Ne
20,179 |
| 3 |
11
натрий
Na
22,98977 |
12
магний
Mg
24,305 |
13
алюминий
Al
26,98154 |
14
кремний
Si
28,0855 |
15
фосфор
P
30,97376 |
16
сера
S
32,06 |
17
хлор
Cl
35,453 |
18
аргон
Ar
39,948 |
4 |
19
калий
K
39,0983 |
20
кальций
Ca
40,08 |
и так далее |
Атомный номер кислорода в Периодической таблице – 8. Следовательно, ядро атома кислорода содержит 8 протонов, а электронная оболочка – 8 электронов. Эти электроны расположены по уровням следующим образом:
1s2 2s2 2p4 (жирным шрифтом выделена валентная оболочка).
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя. В этом параграфе вы сможете посмотреть довольно много таких реакций из "Единой коллекции цифровых образовательных ресурсов".
Хорошие окислительные свойства кислорода и его высокая электроотрицательность в соединениях с другими элементами имеют общую природу. Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга (3,44 по сравнению с 3,98 у фтора). Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления.
 Например, сера расположена в той же VI группе, что и кислород, на одну клеточку ниже. Сера обладает аналогичной внешней электронной оболочкой 3s2 3p4, но эта валентная оболочка расположена дальше от ядра, поэтому в реакции с кислородом сера отдает электроны (служит восстановителем):
Например, сера расположена в той же VI группе, что и кислород, на одну клеточку ниже. Сера обладает аналогичной внешней электронной оболочкой 3s2 3p4, но эта валентная оболочка расположена дальше от ядра, поэтому в реакции с кислородом сера отдает электроны (служит восстановителем):
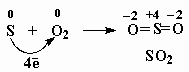
Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Это легко объяснить тем, что фтору до завершения октета нужен всего 1 электрон (расстояние от валентной оболочки до ядра у фтора и кислорода – наименьшие в группах, их валентные оболочки имеют одинаковое главное квантовое число). Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления. В качестве примера приведем соединение F2O:
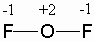
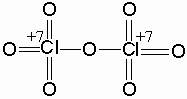
Но уже в реакциях с хлором кислород способен быть окислителем. Например, существует соединение Cl2O7, называемое семиокисью хлора. В этом веществе уже все 7 электронов хлора частично смещены от атома хлора к к атомам кислорода:
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.

 Многие реакции окисления протекают бурно, с выделением большого количества тепла и света. В быту мы называем такие реакции горением. В кислороде сгорают сера (см. выше), фосфор, уголь, бензин, метан:
Многие реакции окисления протекают бурно, с выделением большого количества тепла и света. В быту мы называем такие реакции горением. В кислороде сгорают сера (см. выше), фосфор, уголь, бензин, метан:
|
4 P |
+ |
5 O2 |
= |
2 P2O5 |
|
фосфор |
|
|
|
оксид фосфора (V) |
|
C |
+ |
O2 |
= |
CO2 |
|
углерод |
|
|
|
оксид углерода (IV) |
|
2 C8H18 |
+ |
25 O2 |
= |
16 CO2 |
+ |
18 H2O |
|
бензин |
|
|
|
оксид углерода (IV) |
|
вода |
|
CH4 |
+ |
2 O2 |
= |
CO2 |
+ |
2 H2O |
|
метан |
|
|
|
оксид углерода (IV) |
|
вода |
Быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и, как правило, света, называется горением.
 Даже железо способно гореть в атмосфере чистого кислорода. Если сильно нагреть кончик железной проволоки и опустить ее в сосуд с кислородом, то железо загорится, разбрасывая в виде ярких искр частички раскаленной железной окалины:
Даже железо способно гореть в атмосфере чистого кислорода. Если сильно нагреть кончик железной проволоки и опустить ее в сосуд с кислородом, то железо загорится, разбрасывая в виде ярких искр частички раскаленной железной окалины:
|
3 Fe |
+ |
2 O2 |
= |
Fe3O4 (или FeO×
Fe2O3) |
|
железо |
|
|
|
железная окалина: смесь оксидов железа (II) и железа (III) |

Окисление может происходить и медленно, без горения. Например, медь при нагревании в кислороде (и на воздухе) не горит, а "спокойно" превращается в черный порошок оксида меди:
2Cu + O2 = 2CuO
Известно, что железо на воздухе ржавеет, особенно в воде, при высокой влажности. Эта реакция родственна горению железа в кислороде, хотя протекает гораздо медленнее:
4Fe + 3O2 + 2nH2O = 2Fe2O3×
nH2O (ржавчина – гидрат оксида железа III)
 Ржавление металлов называется коррозией. Коррозия причиняет колоссальный вред человеческой цивилизации. Каждый десятый металлургический завод работает только на восполнение потерь от коррозии, потому что ежегодно она уничтожает миллионы тонн металла. На фотографии слева можно
Ржавление металлов называется коррозией. Коррозия причиняет колоссальный вред человеческой цивилизации. Каждый десятый металлургический завод работает только на восполнение потерь от коррозии, потому что ежегодно она уничтожает миллионы тонн металла. На фотографии слева можно
видеть, как происходит постепенное разрушение корпуса старого автомобиля кислородом и водой.
Защитой от коррозии служат различные покрытия. Например, масляные краски и полимерные лаки спасают металлические изделия от коррозии потому, что не дают атмосферному кислороду соприкасаться с поверхностью металла.
Медленное окисление (без горения) происходит не только при ржавлении металла. Органические вещества тоже способны медленно окисляться кислородом воздуха. Например, пропитанные машинным маслом тряпки после обтирки станков и машин на предприятиях запрещено накапливать в кучах. Внутри такой кучи процесс медленного окисления с выделением тепла настолько повышает температуру, что может произойти самовозгорание. Другими словами, медленное окисление способно при определенных условиях перейти в горение.

 ** Еще одним проявлением сильных окислительных свойств кислорода является его способность взрываться в смеси с некоторыми восстановителями. Так, смесь кислорода (или даже воздуха) с водородом называют гремучим газом. Гремучий газ взрывается от малейшей искры. При этом происходит образование воды:
** Еще одним проявлением сильных окислительных свойств кислорода является его способность взрываться в смеси с некоторыми восстановителями. Так, смесь кислорода (или даже воздуха) с водородом называют гремучим газом. Гремучий газ взрывается от малейшей искры. При этом происходит образование воды:
О2 + 2Н2 = 2Н
2О
Близкими свойствами обладают смеси природного газа или угольной пыли с атмосферным воздухом, содержащим всего чуть более 20 % кислорода. Вот почему необходимо постоянно следить за исправностью газовых плит и газовых трубопроводов, находящихся в закрытых помещениях. Шахты постоянно проветриваются мощными насосами не только для того, чтобы в них легче дышалось, но и для того, чтобы разбавить до безопасных пределов рудничный газ (метан), выделяющийся из угольных пластов.
Вентили и трубопроводы, через которые подается чистый кислород, не должны содержать даже следов смазки. Органическое вещество (например, машинное масло) раздробленное на мелкие капли в токе кислорода, становится взрывчаткой огромной разрушительной силы.
Обыкновенные древесные опилки, пропитанные жидким кислородом, становятся взрывчатым веществом. Поэтому смеси пористых горючих материалов с жидким кислородом применяют в качестве взрывчатки при прокладке тоннелей, при строительстве плотин для гидростанций, при добыче руды или камня в карьерах.
Задачи.
6.6. Уравняйте следующие реакции с участием кислорода:
а) Li + O2 = Li2O
б) NH3 + O2 = N2 + H2O
в) NH3 + O2 = NO + H2O (идет с катализатором)
г) NO2 + H2O + O2 = HNO3
д) AgNO3 = Ag + NO2 + O2 (при нагревании)
е) PH3 + O2 = P2O5 + H2O
ж) P2O3 + O2 = P2O5
6.7. Исходя из электронного строения атомов элементов и закономерностей Периодической таблицы, напишите молекулярные формулы соединений кислорода со следующими элементами: кремнием (Si), селеном (Se) (два), стронцием (Sr), бором (B), скандием Sc.
6.8. После сгорания металлического кальция на воздухе образовался белый порошок массой 5,6 г. Какова была масса металлического кальция, взятого для опыта?
В следующий параграф.
_________________