§6.6 Озон.
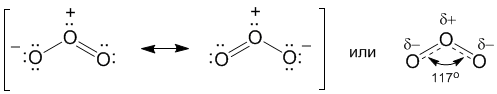
С озоном вы уже знакомились в главе 1, когда мы рассказывали о составе атмосферного воздуха, в котором озон присутствует в виде незначительной примеси. В чистом виде озон O3 – голубой газ с резким запахом (греческое озос – пахучий). Строение молекулы озона можно изобразить разными способами. Например, комбинацией двух крайних (или резонансных) структур. Каждая из таких структур не существует в реальности (это как бы "чертеж" молекулы), а настоящая молекула представляет собой нечто среднее между двумя резонансными структурами.

Хотя молекулярный кислород и озон составлены из атомов одного и того же элемента кислорода – это разные вещества. С таким же явлением на примере углерода мы уже сталкивались в главе 3 (алмаз и графит). Оно называется аллотропией. Графит и алмаз – разные вещества, хотя и тот и другой состоят только из углерода. Теперь мы наблюдаем такое же явление у кислорода.
Если какой-либо элемент образует два или несколько простых веществ, то такие вещества называются аллотропными модификациями. Само это явление называется аллотропией.
Итак, озон и молекулярный кислород – две разные аллотропные модификации элемента кислорода.
В лаборатории озон получают при "тихом" (без искр) электрическом разряде в стеклянной трубке, через которую пропускается ток кислорода. Такой прибор называется озонатором. Есть и другие лабораторные способы получения озона.
** Кому-то из читателей (особенно участникам химических олимпиад) наверняка знаком классический способ получения пероксида водорода H2О2 из пероксида бария BaO2 при действии разбавленной серной кислоты.
BaO2 + H2SO4 (разб.) = BaSO4↓ + H2О2 (раствор)
Пероксиды – это вещества, содержащие связь О–О. Интересно, что если взять не разбавленную, а концентрированную серную кислоту, то реакция идет по другому пути и образуется озон:
3 BaO2 + 3 H2SO4 = 3 BaSO4↓ + O3↑ + 3 H2O
 Озон обладает более сильными окислительными свойствами, чем кислород. Например, озон способен изменить степень окисления иода от -1 до 0, т.е. окислить анион иода до свободного иода. Свободный иод, в свою очередь, легко обнаружить добавлением крахмала (получается темно-синий иодкрахмальный комплекс). Этот способ можно использовать для обнаружения озона – посмотрите опыт из "Единой коллекции образовательных ресурсов".
Озон обладает более сильными окислительными свойствами, чем кислород. Например, озон способен изменить степень окисления иода от -1 до 0, т.е. окислить анион иода до свободного иода. Свободный иод, в свою очередь, легко обнаружить добавлением крахмала (получается темно-синий иодкрахмальный комплекс). Этот способ можно использовать для обнаружения озона – посмотрите опыт из "Единой коллекции образовательных ресурсов".
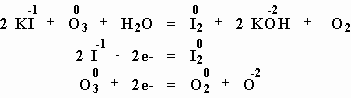
Резина быстро разрушается в атмосфере озона, а спирт при соприкосновении с ним воспламеняется. В чем же причина такой высокой окислительной способности озона?
Молекула озона относительно устойчива, однако под влиянием катализаторов (ими может служить целый ряд веществ) она легко разлагается с выделением атомарного кислорода - более сильного окислителя, чем молекулярный кислород:
O3 = O2 + O
Из-за своей высокой окислительной способности озон довольно токсичен для живых организмов. Если его содержание в помещении повышается до 10–4 % по объему (а это совсем мало по сравнению с 21% кислорода в воздухе), то человек испытывает головную боль и другие признаки химического отравления. В России и СНГ предельно допустимая разовая концентрация озона составляет 0,08×10–4 %, в Европейском Союзе - 0,09×10–4 %, в США – 0,24×10–4 % по объему.
С другой стороны, способность озона разлагаться с образованием атомарного кислорода делает его почти идеальным средством для обеззараживания питьевой воды. Озон убивает болезнетворные бактерии окислением, частично превращаясь при этом в молекулярный кислород. Поэтому озонированная вода лучше и вкуснее хлорированной, которую до сих пор приходится пить жителям многих городов.
** Почему бы не предположить, что молекула озона имеет циклическое строение – в форме равностороннего треугольника? В такой молекуле валентность всех атомов кислорода была бы равна двум, как и во всех остальных его соединениях. Однако экспериментальные факты не подтверждают эту гипотезу. Во-первых, структурные исследования показали, что молекула представляет собой не равносторонний, а равнобедренный треугольник, один из углов которого намного больше 60o. Во-вторых, длина связи кислород-кислород (1,28 А) скорее соответствует кратной, а не простой связи (напомним, что длина простой связи О–О в H2O2 заметно больше – 1,48 А). В-третьих, молекула озона полярна. Все эти факты объясняют приведенные в начале параграфа формулы. Так, разделение зарядов "+" и "–" в резонансных структурах позволяет объяснить полярность молекулы озона (из-за этого озон намного лучше, чем O2, растворяется в воде). Кроме того, такое разделение зарядов эквивалентно еще одной химической связи и можно говорить, что у центрального атома кислорода валентность (IV). Аналогичная ситуация реализуется при образовании молекулы SO2, однако у атома серы валентность (IV) появляется благодаря переходу электрона с подуровня 3p на 3d (вспомните §3.5, где приведены нужные орбитальные диаграммы). Но у кислорода на 2-м уровне нет d-орбиталей! Как же в этом случае реализуется его четырехвалентное состояние? Вероятно, благодаря переходу электрона с уровня 2p на 3s в атоме кислорода. Эти уровни уже значительно отличаются по энергии, поэтому такой переход должен требовать больших энергетических затрат. Эксперимент говорит о том, что образование озона действительно требует поглощения большого количества энергии.
Основная масса природного озона образуется в верхних слоях атмосферы из молекул O2 в результате поглощения "жесткого" (т.е. несущего много энергии) ультрафиолетового излучения Солнца:
Земная атмосфера имеет слоистое строение. Основные ее слои - тропосфера и стратосфера. Тропосфера простирается от уровня моря до высоты 8 - 17 км (в зависимости от широты) - здесь сосредоточено примерно 4/5 массы всей атмосферы. Стратосфера – это безоблачная, сухая, холодная область над тропосферой до высоты примерно 40 - 50 км. Более 90% озона на нашей планете – это стратосферный озон.
Для характеристики содержания озона используют сокращенный темин - ОСО (общее содержание озона). Количественно ОСО выражают толщиной слоя озона, который получился бы, если бы весь содержащийся в атмосфере озон привести к нормальному давлению при температуре 0o С. В среднем по земному шару она равна 3 мм, но может изменяться от 1 мм (в Антарктиде в период весенней озоновой аномалии) до 6 мм (в конце зимы – начале весны над Дальним Востоком). ОСО измеряют в так называемых единицах Добсона (е.Д.). Приведенная толщина слоя озона 3 мм соответствует 300 е.Д.
Несмотря на то, что в стратосфере озона относительно мало, он играет чрезвычайно важную роль в защите живых организмов от губительного ультрафиолетового излучения Солнца. Образование озона - эндотермическая реакция. Она происходит при поглощении энергии опасных для всего живого квантов УФ-света с длиной волны менее 180 нм (вспомните рис. 2-12 из главы 2, показывающий диапазоны солнечного спектра). Таким образом, озон служит "фильтром" опасного УФ-излучения. Заметную роль играет озон и в тепловом балансе Земли. Вы уже знаете, что образование озона – эндотермическая реакция, его разложение – реакция экзотермическая, происходящая с выделением тепла. По разным оценкам от 5 до 8% разогрева земной атмосферы за счет парниковых газов приходится на превращения озона. Катализаторами разложения озона в стратосфере могут служить атомарный хлор и другие, самые разнообразные вещества. Много таких веществ среди промышленных выбросов в атмосферу.
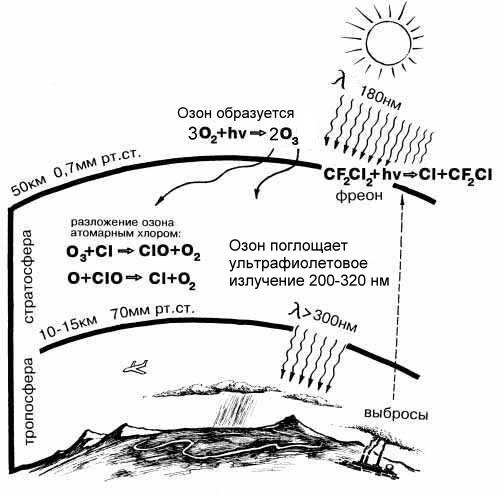
Рис. 6-7. Озон образуется под действием ультрафиолетовых лучей с длиной волны менее 180 нм. УФ-свет с большей длиной волны (около 320 нм), наоборот, способствует разложению озона. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов. Когда мы загораем на солнце, на нашу кожу падают "мягкие" ультрафиолетовые лучи, не способные принести вреда здоровью (если загорать в меру).
** Трудно сегодня найти человека, который бы не слышал об "озоновых дырах". Это явление, называемое учеными озоновой аномалией, заключается в опасном снижении концентрации озона в стратосфере над тем или иным районом планеты. Наиболее широко известна "озоновая дыра" над Антарктидой. Когда после долгой полярной ночи в высоких широтах Южного полушария наступает весна (это период с августа по декабрь), над обширным районом Антарктиды площадью более 10 млн. км2 из года в год наблюдается снижение ОСО до 220, а иногда даже до 80 е.Д. (единиц Добсона - см. выше). При этом на высоте 15-20 км наблюдается локальный минимум содержания озона, что говорит о наличии здесь мощного источника его разрушения. Одновременно с появлением озоновой аномалии в нижней стратосфере фиксируются очень низкие температуры (ниже –78o С) и появление полярных стратосферных облаков. По мнению ряда ученых, на поверхности этих облаков происходят фотохимические реакции, разрушающие озон, а катализаторами разрушения выступают хлор- и фторсодержащие вещества, попадающие сюда с других континентов.
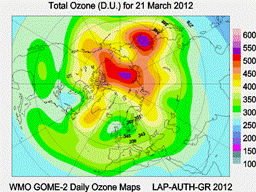 В Северном полушарии в осенне-зимний период тоже иногда образуются "небольшие" озоновые дыры с ОСО меньше 220 е.Д. и площадью до 2 млн. км2. Они обычно зарождаются над Северной Атлантикой и "живут" не больше недели. Всемирная метеорологическая организация (World Meteorogical Organization) с помощью спутников постоянно следит за состоянием озонового слоя нашей планеты. На сайте Центра озонного картирования (Ozone Mapping Centre) ежедневно обновляется информация о состоянии озонового слоя. Рядом с картой распределения озона приводится цветная шкала в единицах Добсона (е.Д.), с которыми вы уже знакомы.
В Северном полушарии в осенне-зимний период тоже иногда образуются "небольшие" озоновые дыры с ОСО меньше 220 е.Д. и площадью до 2 млн. км2. Они обычно зарождаются над Северной Атлантикой и "живут" не больше недели. Всемирная метеорологическая организация (World Meteorogical Organization) с помощью спутников постоянно следит за состоянием озонового слоя нашей планеты. На сайте Центра озонного картирования (Ozone Mapping Centre) ежедневно обновляется информация о состоянии озонового слоя. Рядом с картой распределения озона приводится цветная шкала в единицах Добсона (е.Д.), с которыми вы уже знакомы.
Ряд исследователей считает, что возникновение озоновых дыр связано не столько с загрязнением атмосферы хлор- и фторуглеводородами, сколько с особенностями атмосферной циркуляции в различных районах Земли. Вопрос пока остается открытым. Впрочем, снижение промышленного загрязнения атмосферы в любом случае пошло бы на пользу климату и биосфере нашей планеты.
Вполне вероятно, что проблема промышленных выбросов в атмосферу – это не только проблема загрязнения поверхности Земли вредными веществами, но еще и проблема "загрязнения" солнечного спектра жестким, вредным для человека ультрафиолетовым излучением в результате частичного разрушения озонового слоя.
Но не стоит и преувеличивать опасность: полное исчезновение озона не грозит атмосфере до тех пор, пока в ней есть кислород и пока светит Солнце.
_________________
Авторы признательны сотруднику Центральной аэрологической обсерватории, специалисту в области мониторинга атмосферного озона А. М. Звягинцеву за ценные замечания. На сайте ЦАО www.cao-rhms.ru вы можете больше узнать об атмосферном озоне.
_________________