§8.3 Кислоты. Классификация кислот. Химические свойства
.Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык
– среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как уксусная (содержится в столовом уксусе), яблочная, лимонная, аскорбиновая (витамин С), щавелевая и некоторые другие (эти кислоты содержатся в растениях) знакомы вам именно своим кислым вкусом.В этом параграфе мы рассмотрим только важнейшие неорганические кислоты, то есть такие, которые не синтезируются живыми организмами, но играют большую роль в химии и химической промышленности.
Все кислоты, независимо от их происхождения, объединяет общее свойство
– они содержат реакционноспособные атомы водорода. В связи с этим кислотам можно дать следующее определение:Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов. Например:
|
H2SO4 |
+ |
Mg |
= |
MgSO4 |
+ |
H2 |
|
серная кислота |
металл |
соль |
водород |
|
H2SO4 |
+ |
MgO |
= |
MgSO4 |
+ |
H2O |
|
серная кислота |
оксид |
соль |
вода |
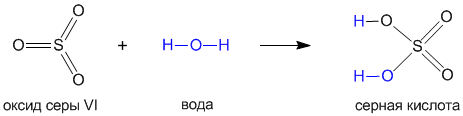
Давайте на примере серной кислоты рассмотрим ее образование из кислотного оксида SO3, а затем реакцию серной кислоты с магнием. Валентности всех элементов, участвующих в реакции, нам известны, поэтому напишем соединения в виде структурных формул:

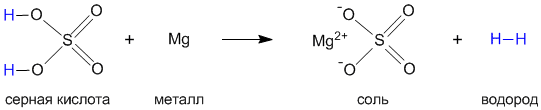
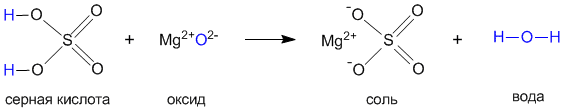
Эти примеры позволяют легко проследить связь между кислотным оксидом SO
3, кислотой H2SO4 и солью MgSO4. Одно "рождается" из другого, причем атом серы и атомы кислорода переходят из соединения одного класса (кислотный оксид) в соединения других классов (кислота, соль).Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле, б) по числу атомов водорода, в) по силе.
а) По первому признаку кислоты делятся на кислородсодержащие и бескислородные (табл. 8-1).
Таблица 8-1. Классификация кислот по составу.
|
Кислородсодержащие кислоты |
Бескислородные кислоты |
|
H2SO4 серная кислота H2SO3 сернистая кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота |
HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
б) По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н), как показано в табл. 8-2:
Таблица 8-2. Классификация кислот по числу атомов водорода.
|
К И С Л О Т Ы |
||
|
Одноосновные |
Двухосновные |
Трехосновные |
|
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная |
H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
H3PO4 фосфорная |
** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + H2O
HCl + KOH = KCl + H2O
Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная
– "три основания":H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H3PO4 + 3 NaOH = Na3PO4 + 3 H2O
в) По силе кислоты различают в зависимости от их способности распадаться на ионы Н+ и ионы кислотных остатков (в растворе или даже в чистом виде). Сильные кислоты хорошо распадаются (диссоциируют) на ионы, а слабые - плохо. При этом силу кислот можно оценить количественно. Однако нам лучше разобраться в этом уже после изучания химического равновесия (глава 9), поскольку диссоциация веществ на ионы - это обратимая химическая реакция, описать которую можно не только химическими уравнениями, но и математически (что что и будет сделано в главе 10 - §10.1-10.3). Здесь мы приведем лишь качественную картину: в таблице 8-3 в каждой из колонок сила кислот уменьшается сверху вниз.
Таблица 8-3. Классификация кислот на сильные и слабые кислоты.
|
Сильные кислоты |
Слабые кислоты |
|
HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная |
HF фтороводородная H3PO4 фосфорная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая CH3COOH уксусная и другие органические кислоты |
Рассмотрим важнейшие химические свойства кислот.
 1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов (см. §8.5). По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов (см. §8.5). По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
Индикаторы представляют собой вещества сложного строения. В растворах оснований и в нейтральных растворах они имеют иную окраску, чем в растворах кислот.
2. Взаимодействие кислот с основаниями. Эта реакция, как вы уже знаете, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Например:
|
кислота |
основание |
соль |
вода |
|||
|
H2SO4 |
+ |
Ca(OH)2 |
= |
CaSO4 |
+ |
2 H2O |
|
H3PO4 |
+ |
Fe(OH)3 |
= |
FePO4 |
+ |
3 H2O |
|
2 H3PO4 |
+ |
3 Ca(OH)2 |
= |
Ca3(PO4)2 |
+ |
6 H2O |
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH:
H2SiO3 + 2 NaOH = Na2SiO3 + 2H2O
 3. Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
3. Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
|
кислота |
оксид |
соль |
вода |
|||
|
2 HCl |
+ |
CaO |
= |
CaCl2 |
+ |
H2O |
|
2 H3PO4 |
+ |
Fe2O3 |
= |
2 FePO4 |
+ |
3 H2O |
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
 4. Взаимодействие кислот с металлами. Как мы видим из предыдущего примера, для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
4. Взаимодействие кислот с металлами. Как мы видим из предыдущего примера, для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла.
|
кислота |
металл |
соль |
||||
|
HCl |
+ |
Hg |
= |
не образуется |
||
|
2 HCl |
2 Na |
= |
2 NaCl |
+ |
H2 |
|
|
H2SO4 |
+ |
Zn |
= |
ZnSO4 |
+ |
H2 |
По реакционной способности в отношении кислот все металлы располагаются в ряд активности металлов (табл. 8-4). Слева находятся наиболее активные металлы, справа
– неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами.Табл. 8-4. Ряд активности металлов.
|
Металлы, которые вытесняют водород из кислот |
Металлы, которые не вытесняют водород из кислот |
|
K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) ¬ самые активные металлы |
Cu Hg Ag Pt Au самые неактивные металлы ® |
Во-вторых, кислота должна быть достаточно сильной (см. табл. 8-3), чтобы реагировать с металлом из левой части табл. 8-4. Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать).
С другой стороны, такие сильные кислоты как серная или соляная (хлороводородная) способны реагировать со всеми металлами из левой части табл.
8-4.** Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Это связано с тем, что азотная кислота содержит в своей молекуле сильный окислитель
– азот в степени окисления +5. Поэтому с металлами в первую очередь реагирует более активный окислитель N+5, а не H+, как в других кислотах. Выделяющийся все же в каком-то количестве водород немедленно окисляется и не выделяется в виде газа. Это же наблюдается и для реакций концентрированной серной кислоты, в молекуле которой сера S+6 также выступает в роли главного окислителя. Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например:Cu + 4 HNO3
(конц.) = Cu(NO3)2 + 2 NO2 + 2 H2O3 Cu + 8HNO3
(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2OZn + 4 HNO3
(конц.) = Zn(NO3)2 + 2 NO2 + 2 H2O8 K + 5 H2SO4(
конц.) = 4 K2SO4 + H2S + 4 H2O3 Zn + 4 H2SO4
(конц.) = 3 ZnSO4 + S + 4 H2OЕсть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами – серной кислотой и азотной кислотой.
 Эти металлы – Al, Fe, Cr, Ni и некоторые другие
Эти металлы – Al, Fe, Cr, Ni и некоторые другие
Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках.
Задачи.
8.10. Напишите реакции нейтрализации между кислотами и основаниями, в результате которых получаются следующие соли: Al
2(SO4)3, NiCO3, Fe(NO3)3, Mg3(PO4)2, PbS, Li2SO4.8.11. Сколько P
2O5 необходимо для получения 392 кг фосфорной кислоты H3PO4 ?** 8.12 (ФМШ). При растворении в H
2SO4 10,48 г смеси оксидов CuO и ZnO образовалось 20,88 г смеси безводных сульфатов CuSO4 и ZnSO4. Определите состав взятой смеси.** 8.13. Напишите формулы водородных соединений пяти элементов главной подгруппы VI группы. Все они в той или иной мере являются кислотами. Исходя из закономерностей Периодической таблицы, расположите эти кислоты в ряд от самой слабой до самой сильной кислоты.
_________________