 Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
Любая химическая реакция заключается в разрыве одних химических связей и образовании других.§9.1 Тепловой эффект химической реакции. Основные законы термохимии.
Раньше мы лишь коротко упоминали о реакциях, идущих с выделением или поглощением тепла (см. §5.3). Теперь рассмотрим это явление более подробно, уже на количественном уровне.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Энергия химических соединений сосредоточена главным образом в химических связях. Чтобы разрушить связь между двумя атомами, требуется ЗАТРАТИТЬ ЭНЕРГИЮ. Когда химическая связь образуется, энергия ВЫДЕЛЯЕТСЯ.
Вспомним, что атомы не соединялись бы между собой, если бы это не вело к "выигрышу" (то есть высвобождению) энергии. Этот выигрыш может быть большим или малым, но он обязательно есть при образовании молекул из атомов.
 Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения "старых" связей в исходных веществах, то избыток энергии высвобождается в виде тепла. Примером могут служить реакции горения.
Например, природный газ (метан CH4) сгорает в кислороде воздуха с выделением большого количества теплоты (рис. 9-1а). Реакция даже может идти со взрывом - так много энергии заключено в этом превращении. Такие реакции называются ЭКЗОТЕРМИЧЕСКИМИ от латинского "экзо" - наружу (имея в виду выделяющуюся энергию).
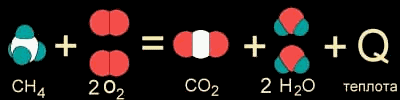
Рис. 9-1а. Уравнение экзотермической реакции горения метана.
В других случаях на разрушение связей в исходных веществах требуется энергии больше, чем может выделиться при образовании новых связей. Такие реакции происходят только при подводе энергии извне и называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании (рис. 9-1б).
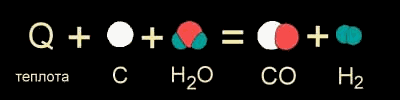
Рис. 9-1б. Уравнение эндотермической реакции между углем и водой при высокой температуре.
На рис. 9-1а,б уравнения химических реакций изображены с помощью моделей молекул. Модели наглядно показывают, как при неизменном числе атомов между ними разрушаются старые и возникают новые химические связи.
Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Такая величина называется ТЕПЛОВЫМ ЭФФЕКТОМ РЕАКЦИИ. Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений:
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
или
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж
Оба уравнения одинаково правильны и оба выражают тепловой эффект экзотермической реакции образования воды из водорода и кислорода. Первое - на 1 моль использованного кислорода, а второе - на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды.
Значки (г), (ж) обозначают газообразное и жидкое состояние веществ. Встречаются также обозначения (тв) или (к) - твердое, кристаллическое вещество, (водн) - растворенное в воде вещество и т.д.
Обозначение агрегатного состояния вещества имеет важное значение. Например, в реакции сгорания водорода первоначально образуется вода в виде пара (газообразное состояние), при конденсации которого может выделиться еще некоторое количество энергии. Следовательно, для образования воды в виде жидкости измеренный тепловой эффект реакции будет несколько больше, чем для образования только пара, поскольку при конденсации пара выделится еще порция теплоты.
Используется также частный случай теплового эффекта реакции - ТЕПЛОТА СГОРАНИЯ. Из самого названия видно, что теплота сгорания служит для характеристики вещества, применяемого в качестве топлива. Теплоту сгорания относят к 1 молю вещества, являющегося топливом (восстановителем в реакции окисления), например:
|
C2H2 |
+ |
2,5 O2 |
= |
2 CO2 |
+ |
H2O |
+ |
1300 кДж |
|
ацетилен |
теплота сгорания ацетилена |
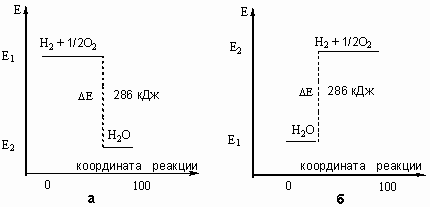
Рис. 9-2. Графическое изображение теплового эффекта
(Q = ΔЕ): а) экзотермической реакции горения водорода; б) эндотермической реакции разложения воды под действием электрического тока. Координату реакции (горизонтальную ось графика) можно рассматривать, например, как степень превращения веществ (100% - полное превращение исходных веществ).Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы (рис.9-3).

Рис. 9-3. Одна из самых мощных в мире ракет - российская "Энергия" перед стартом на космодроме Байконур. Двигатели одной из её ступеней работали на сжиженных газах - водороде и кислороде.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект
- это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей - спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы - калории (1 кал = 4,18 Дж). Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке баночки со сгущенным молоком можно прочитать такую надпись: "калорийность 320 ккал/100 г".
Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ.
Особенность термохимических уравнений заключается в том, что при работе с ними можно переносить формулы веществ и величины тепловых эффектов из одной части уравнения в другую. С обычными уравнениями химических реакций так поступать, как правило, нельзя.
Допускается также почленное сложение и вычитание термохимических уравнений. Это бывает нужно для определения тепловых эффектов реакций, которые трудно или невозможно измерить в опыте.
Приведем пример. В лаборатории чрезвычайно трудно осуществить "в чистом виде" реакцию получения метана СH
4 путем прямого соединения углерода с водородом:С + 2 H
2 = СH4Но можно многое узнать об этой реакции с помощью вычислений. Например, выяснить, будет эта реакция экзо- или эндотермической, и даже количественно рассчитать величину теплового эффекта.
Известны тепловые эффекты реакций горения метана, углерода и водорода (эти реакции идут легко):
а) СH
4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДжб) С(тв) + O
2(г) = СO2(г) + 394 кДжв) 2 H
2(г) + O2(г) = 2 H2О(ж) + 572 кДжВычтем два последних уравнения (б) и (в) из уравнения (а) Левые части уравнений будем вычитать из левой, правые
- из правой. При этом сократятся все молекулы O2, СO2 и H2О. Получим:СH
4(г) - С(тв) - 2 H2(г) = (890 - 394 - 572) кДж = -76 кДжЭто уравнение выглядит несколько непривычно. Умножим обе части уравнения на (
-1) и перенесем CH4 в правую часть с обратным знаком. Получим нужное нам уравнение образования метана из угля и водорода:С(тв) + 2 H
2(г) = CH4(г) + 76 кДж/мольИтак, наши расчеты показали, что тепловой эффект образования метана из углерода и водорода составляет 76 кДж (на моль метана), причем этот процесс должен быть экзотермическим (энергия в этой реакции будет выделяться).
Обратите внимание, что почленно складывать, вычитать и сокращать в термохимических уравнениях можно только вещества, находящиеся в одинаковых агрегатных состояниях, иначе мы ошибемся в определении теплового эффекта на величину теплоты перехода из одного агрегатного состояния в другое.
Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ. Существует два важнейших закона термохимии. Первый из них, закон Лавуазье–Лапласа, формулируется следующим образом:
# Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
Это означает, что при образовании любого соединения выделяется (поглощается) столько же энергии, сколько поглощается (выделяется) при его распаде на исходные вещества. Например
:2 H2(г) + O2(г) 2 H2О(ж) + 572 кДж (горение водорода в кислороде)
2 H2О(ж) + 572 кДж = 2 H2(г) + O2(г) (разложение воды электрическим током)
Закон Лавуазье–Лапласа является следствием закона сохранения энергии.
Второй закон термохимии был сформулирован в 1840 г российским химиком, академиком Г. И. Гессом:
# Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Это означает, что общий тепловой эффект ряда последовательных реакций будет таким же, как и у любого другого ряда реакций, если в начале и в конце этих рядов одни и те же исходные и конечные вещества.
Рассмотрим пример, поясняющий закон Гесса. Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Один путь включает только одну стадию, а во второй - две стадии, с промежуточным получением кислой соли NaHSO4:
Первый путь (одностадийный):
2 NaOH (водн) + H2SO4 (водн) = Na2SO4 (водн) + 2 H2O (ж) + 113,6 кДж;
Второй путь (двухстадийный):
а) NaOH (водн) + H2SO4 (водн) = NaНSO4 (водн) + H2O (ж) + 34,9 кДж
б) NaHSO4 (водн) + NaOH (водн) = Na2SO4 (водн) + H2O (ж) + 78,7 кДж
Согласно закону Гесса, тепловой эффект получения сульфата натрия из NaOH не зависит от способа получения. Действительно, складывая тепловые эффекты двух последовательных реакций во втором способе мы получаем тот же тепловой эффект, что и для первого способа: 34,9 кДж + 78,7 кДж = 113,6 кДж1. Кстати, почленное сложение двух последних уравнений дает первое уравнение реакции.
Именно эти два основных закона термохимии придают термохимическим уравнениям некоторое сходство с математическими, когда в уравнениях реакций можно переносить члены из одной части в другую, почленно складывать, вычитать и сокращать формулы химических соединений. При этом необходимо учитывать коэффициенты в уравнениях реакций и не забывать о том, что складываемые, вычитаемые или сокращаемые моли вещества должны находиться в одинаковом агрегатном состоянии.
 ** Кому-то из вас интересно узнать, как экспериментально можно измерить тепловой эффект химической реакции. Рассмотрим это на примере экзотермической реакции между металлическим алюминием и оксидом железа. Для измерения теплоты Q используют специальный прибор - калориметр. Представьте себе большую "кастрюлю", обернутую теплоизолирующим материалом, чтобы тепло не могло проникать сквозь стенки ни внутрь, ни наружу. Крышка прибора тоже теплоизолирована. В калориметр помещают лед и воду. Через некоторое время внутри прибора устанавливается постоянная температура: 0 оС. Воду можно выливать из калориметра через специальный кран, а взвешенный на весах лед добавлять, подняв крышку. Поместим в калориметр "бомбу" - герметичный сосуд, содержащий 5,40 г алюминия и 15,97 г оксида железа
** Кому-то из вас интересно узнать, как экспериментально можно измерить тепловой эффект химической реакции. Рассмотрим это на примере экзотермической реакции между металлическим алюминием и оксидом железа. Для измерения теплоты Q используют специальный прибор - калориметр. Представьте себе большую "кастрюлю", обернутую теплоизолирующим материалом, чтобы тепло не могло проникать сквозь стенки ни внутрь, ни наружу. Крышка прибора тоже теплоизолирована. В калориметр помещают лед и воду. Через некоторое время внутри прибора устанавливается постоянная температура: 0 оС. Воду можно выливать из калориметра через специальный кран, а взвешенный на весах лед добавлять, подняв крышку. Поместим в калориметр "бомбу" - герметичный сосуд, содержащий 5,40 г алюминия и 15,97 г оксида железа
2
Al(тв) + Fe2O3(тв) = Al2O3(тв) + 2 Fe(тв) + Q кДжДопустим, что к моменту начала реакции в калориметре находится 8,000 кг льда и 8,000 кг жидкой воды. После окончания реакции и остывания "бомбы" до 0 оС мы установили, что в калориметре находится 8,254 кг жидкой воды (и, соответственно, 7,746 кг льда). Таким образом, расплавилось 0,254 кг льда, теплота плавления которого составляет 335 Дж
/г (или 335 кДж/кг). Следовательно, в реакции выделилось 0,254 кг ×335 кДж/кг = 85,1 кДж теплоты. Поскольку для эксперимента мы взяли ровно 0,2 моля Al и 0,1 моль Fe2O3 (посчитайте сами и убедитесь, что число молей пропорционально коэффициентам в уравнении реакции), то тепловой эффект исследуемой реакции в данных условиях составляет 851 кДж (реакция экзотермическая):2
Al(тв) + Fe2O3(тв) = Al2O3(тв) + 2 Fe(тв) + 851 кДжЧаще используют не ледяные калориметры, а более удобные – наполненные водой (рис. 9-4). В этом случае о количестве выделившейся теплоты судят по повышению температуры жидкости.
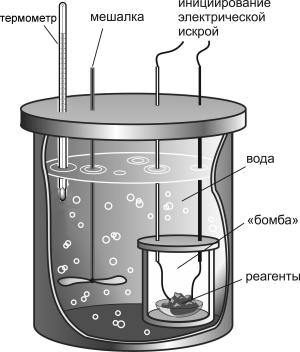
Рис. 9-4. Устройство водяного калориметра.
Количество теплоты Q = mc(t2 - t1), где m – масса воды в калориметре, c – её удельная теплоемкость, t1 – температура воды до начала реакции и t2 – температура воды по окончании реакции.
ЗАДАЧИ
9.1. (НГУ) Определите величину теплового эффекта реакции:
2 S + 3 O2 = 2 SO3
если известны тепловые эффекты реакций
а) S + O
2 = SO2 + 297 кДж/мольб) SO
2 + 0,5 O2 = SO3 + 396 кДж/моль9.2. На основании двух термохимических уравнений определите, что устойчивее - алмаз или графит?
С (графит) + O2 = СO2 + 393,8 кДж
С (алмаз) + O2 = СO2 + 395,7 кДж
9.3
.** (МГУ). Даны три уравнения химических реакций:а) Ca (тв) + 2 H
2O (ж) = Ca(OH)2 (водн) + H2 (г) + 456,4 кДжб) CaO (тв) + H
2O (ж) = Ca(OH)2 (водн) + 81,6 кДжв) H
2 (г) + 1/2 O2 (г) = H2O (ж) + 286 кДжОпределите тепловой эффект реакции: Ca (тв) + 1/
2 O2 (г) = CaO (тв) + Q кДж.1 Тепловые эффекты этих реакций приведены из справочника Lange’s Handbook of Chemistry, 15th Edition / Ed. J. A. Dean. – McGraw-Hill, Inc., 1999. – Table. 6.3.
_________________