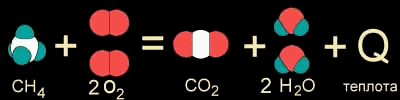
§9.2** Термохимия (продолжение). Теплота образования вещества из элементов. Стандартная энтальпия образования.
В прошлом параграфе мы привели пример вычисления теплового эффекта реакции:
С(тв) + 2 H2(г) = CH4(г) + 76 кДж/моль.
В данном случае 76 кДж - это не просто тепловой эффект данной химической реакции, но еще и теплота образования метана из элементов. Действительно, в этой реакции метан СН4 образуется именно из составляющих его элементов - углерода и водорода, а не каким-нибудь другим способом.
Известны теплоты образования самых разнообразных веществ из составляющих их элементов. Например:
CO2(г): 393,5 кДж/моль (из C и O2, энергия выделяется);
SiO2(тв): 859 кДж/моль (из Si и O2, энергия выделяется);
NaCl (тв): 411 кДж/моль (из моля Na и 0,5 моль Cl2, энергия выделяется) и т.д.
Опубликованы обширные таблицы теплот образования веществ. В чем же полезность этих величин? Дело в том, что теплоты образования веществ из элементов чрезвычайно удобны для расчета тепловых эффектов любых реакций, в которых эти вещества могли бы участвовать. Теплота любой реакции (даже пока не осуществленной на практике) может быть вычислена как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции.
Однако здесь необходимо строго соблюдать "правила игры", принятые в термохимии. Например, мы пишем: "
C(тв)", но "твердый" углерод может быть как графитом, так и алмазом! В термохимических измерениях стандартным состоянием углерода считается графит, а не алмаз. Во-вторых, нужно договориться о температуре и давлении, при которых находятся вещества, поскольку эти параметры могут заметно влиять на величину теплового эффекта. Принято использовать теплоты образования веществ, находящихся в стандартных условиях.1. Стандартные условия: температура 25 оС (298 К) и давление 1 атм.
2. Теплота образования "из самих себя" простых веществ (т.е. чистых элементов) в их наиболее распространенных аллотропных модификациях по определению равна нулю.
Например, тепловой эффект реакции взаимодействия водорода и кислорода с образованием воды (H2 + 0,5 O2 = H2O + Q кДж) мы назовем СТАНДАРТНОЙ ТЕПЛОТОЙ ОБРАЗОВАНИЯ ВОДЫ из элементов при условии, что изначально водород и кислород находились при атмосферном давлении и температуре 25 оС, затем произошла реакция с выделением большого количества теплоты, а затем продукт реакции (вода) вновь был охлажден до 25 оС, отдав все полученное во время реакции тепло в окружающую среду. Этот тепловой эффект, как мы уже знаем, составляет 286 кДж/моль.
Термохимия является частью более обширной науки ТЕРМОДИНАМИКИ. В термодинамике приняты свои термины, к которым читателю надо привыкнуть. Так, тепловой эффект описанной выше реакции получения воды в термодинамике принято называть ЭНТАЛЬПИЕЙ (ΔН) образования воды в том случае, если реакция происходит при неизменном давлении (например, в открытом сосуде). Если реакция проводится в замкнутом сосуде и давление в ходе реакции меняется, то тепловой эффект
(Q) и энтальпия (ΔН) - не совсем одно и то же. Давайте разберемся, зачем понадобилось вводить такое понятие, как энтальпия ΔН (наряду с уже привычным нам тепловым эффектом) и чем они отличаются друг от друга.Дело в том, что наиболее удобным методом измерения тепловых эффектов для химиков
долгое время служил способ проведения реакций в "бомбе" - замкнутом металлическом сосуде, который помещают в калориметр. В конце предыдущего параграфа рассказывалось именно о таком эксперименте (если вы еще не прочитали об этом - вернитесь на один параграф назад). В замкнутом сосуде продукты реакции лишены возможности изменять объем, поэтому они не могут выполнить какую-нибудь МЕХАНИЧЕСКУЮ работу. В этих условиях выделившееся сквозь стенки "бомбы" тепло (назовем его ΔЕ) - это еще не вся энергия, заключавшаяся в данной реакции. Если давление в реакции возрастает, а "бомба" окажется не очень прочной, то её просто-напросто разорвет, причем на эту работу будет потрачено еще какое-то количество энергии, которое мы "не замечаем" в том случае, если "бомба" осталась цела.Но большинство химических реакций химики
проводят не при постоянном объеме (не в "бомбе"), а в открытых сосудах (т.е. при постоянном давлении). Поэтому потребовалась величина, аналогичная ΔЕ, но измеряемая для реакций в открытых сосудах. Именно такая величина называется ЭНТАЛЬПИЕЙ.ЭНТАЛЬПИЯ - это тепловой эффект реакции, измеренный (или вычисленный) для случая, когда реакция происходит в открытом сосуде (т.е. при неизменном давлении). Обозначается как ΔH.
Когда объем, занимаемый продуктами реакции
, отличается от объема, занимаемого реагентами, химическая система может совершить дополнительную работу PΔV (где P - давление, а ΔV - изменение объема). Поэтому ΔН и ΔЕ связаны между собой соотношением:ΔН = ΔЕ + PΔV
Итак, если реакция проводится не в "бомбе", то ЭНТАЛЬПИЯ и ТЕПЛОВОЙ ЭФФЕКТ совпадают между собой. Энтальпию называют также "теплосодержанием". Если мы проводим реакцию получения воды в открытом сосуде, то 286 кДж
/моль - это "тепло" ΔН, содержащееся в водороде и кислороде для случая, когда мы получаем из них воду. Поскольку исходные вещества (водород и кислород) находились в нашем опыте в стандартных условиях (25 оС и давлении 1 атм), а продукт реакции (воду) мы тоже привели к стандартным условиям, мы вправе сказать, что 286 кДж/моль - это СТАНДАРТНАЯ ТЕПЛОТА ОБРАЗОВАНИЯ ВОДЫ или, что то же - СТАНДАРТНАЯ ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ВОДЫ.Если мы будем получать из тех же элементов не воду, а перекись водорода
H2O2, то "теплосодержание" такой химической системы будет иным (187,6 кДж/моль). Во время протекания реакций с образованием 1 моля воды или 1 моля H2O2 освобождается разное количество энергии, чего и следовало ожидать. В дальнейшем стандартную теплоту образования веществ мы чаще будем называть именно стандартной энтальпией образования ΔН. Чтобы подчеркнуть справедливость этой величины только для стандартных условий, в таблицах её обозначают следующим образом:ΔНо298
Маленький индекс "о" рядом с ΔН по традиции символизирует некое стандартное состояние, а цифра 298 напоминает, что значения приведены для веществ при 25 оС (или 298 К). Стандартная энтальпия не обязательно должна быть энтальпией образования вещества из элементов. Можно получить значение стандартной энтальпии ΔНо
298 для любой химической реакции. Но в нашем случае с получением воды из водорода и кислорода мы получили именно стандартную энтальпию образования воды. Записывается это так:H2 + 0,5 O2 = H2O (ΔНо298 = –286 кДж/моль)
Откуда взялся знак "минус" перед значением теплового эффекта? Здесь авторы со вздохом должны сообщить читателю о еще одной особенности представления теплоты (и энтальпии) в термодинамике. Здесь принято потерянную любой системой энергию представлять со знаком "минус". Рассмотрим, например, уже знакомую нам систему из молекул метана и кислорода. В результате экзотермической реакции между ними происходит выделение теплоты:
СH
4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДж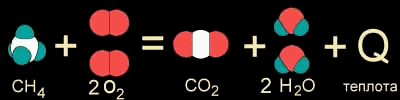
Можно записать эту реакцию и другим уравнением, где выделившаяся (
"потерянная") теплота имеет знак "минус":СH
4(г) + 2 O2(г) – 890 кДж = СO2(г) + 2 H2О(ж)По традиции энтальпию этой и других экзотермических реакций в термодинамике принято записывать со знаком "минус"
:ΔНо298 = –890 кДж/моль (энергия выделяется).
Наоборот, если в результате эндотермической реакции система поглотила энергию, то энтальпия такой эндотермической реакции записывается со знаком "плюс". Например, для уже знакомой нам реакции получения CO и водорода из угля и воды (при нагревании):
C(тв) + H2О(г) + 131,3 кДж = CO(г) + H2(г)
(ΔНо298 = +131,3 кДж/моль)
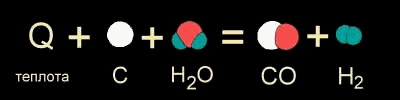
К этой особенности термодинамического языка следует просто привыкнуть, хотя на первых порах путаница со знаками может изрядно досаждать при решении задач.
Давайте попробуем решить одну и ту же задачу сначала в термодинамической шкале (где выделяемая реакцией теплота имеет знак "минус"), а потом в термохимической шкале (которой мы пользовались в предыдущем параграфе и где выделяемая реакцией энергия имеет знак "плюс").
Итак, приведем пример расчета теплового эффекта реакции:
Fe2O3(тв) + 3 C(графит) = 2 Fe(тв) + 3 CO(г)
Эта реакция происходит в мартеновской печи при очень высокой температуре (около 1500 оС). В справочниках, где используется термодинамическая шкала, можно найти стандартные теплоты образования Fe2O3 (ΔНо298 = –822,1 кДж/моль) и СО (ΔНо298 = – 110,5 кДж/моль). Два других вещества из этого уравнения – углерод и железо – являются элементами, то есть их теплота образования по определению равна нулю. Поэтому стандартная теплота рассматриваемой реакции равна:
ΔНо298 = 3× (–110,5) – (–822,1) = –331,5 + 822,1 = +490,6 кДж
Итак, реакция восстановления оксида железа (III) углеродом является эндотермической (ΔНо298 положительна!), причем на восстановление одного моля Fe2O3 тремя молями углерода надо было бы затратить 490,6 кДж, если исходные вещества до начала реакции и продукты после окончания реакции находятся в стандартных условиях (то есть при комнатной температуре и атмосферном давлении). Не имеет значения, что исходные вещества пришлось сильно нагреть для того, чтобы реакция произошла. Величина ΔНо298 = +490,6 кДж отражает "чистый" тепловой эффект эндотермической реакции, в которой реагенты сначала разогревались внешним источником тепла от 25 до 1500 оС, а в конце реакции продукты опять остывали до комнатной температуры, отдав все тепло в окружающую среду. При этом отданного тепла будет меньше, чем пришлось потратить на разогрев, потому что часть тепла поглотилась в реакции.
Проведем тот же расчет, используя термохимическую шкалу. Допустим, известны теплоты сгорания углерода и железа в кислороде (при неизменном давлении):
1) C + 1/2 O2 = CO + 110,5 кДж
2) 2 Fe + 3/2 O2 = Fe2O3 + 822,1 кДж
Чтобы получить тепловой эффект интересующей нас реакции, умножим первое уравнение на 3, а второе перепишем в обратном порядке:
1) 3 C + 3/2 O2 = 3 CO + 331,5 кДж
2) Fe2O3 + 822,1 кДж = 2 Fe + 3/2 O2
Теперь почленно сложим оба уравнения:
3 C + 3/2 O2 + Fe2O3 + 822,1 кДж = 3 CO + 331,5 кДж + 2 Fe + 3/2 O2
После сокращения в обоих частях уравнения кислорода (3
/2 O2) и переноса 822,1 кДж в правую часть получим:3 C + Fe2O3 = 3 CO + 2 Fe – 490,6 кДж
Итак, мы получили тот же самый результат, но уже в термохимической шкале. В уравнениях для простоты мы не указывали каждый раз агрегатное состояние веществ, однако предполагали, что оно одинаковое в разных процессах. Во-вторых, в начале и в конце каждого опыта реагенты и продукты должны находиться в одинаковых (стандартных) условиях – при комнатной температуре и давлении 1 атм..
Читатель должен сам выбрать способ решения термохимических задач, который ему больше по душе. Однако следует помнить, что в современных задачниках чаще используется термодинамическая шкала.
ЗАДАЧИ
Приведенные в этом параграфе задачи взяты из книги: Н. Е. Кузьменко, В. В. Еремин. "2400 задач по химии для школьников и поступающих в вузы". М.: "Дрофа", 1999, с. 59, 63.
9.4. Белый фосфор и черный фосфор – две аллотропные модификации элемента фосфора. Уравнение горения фосфора в кислороде можно представить в виде:
P + 5/4 O2 = 1/2 P2O5
При стандартных условиях теплота сгорания белого фосфора равна 760,1 кДж
/моль, а теплота сгорания черного фосфора равна 722,1 кДж/моль. Чему равна теплота превращения черного фосфора в белый при стандартных условиях?9.5. Какие из нижеприведенных реакций являются эндотермическими?
а) 1/2 N2 + O2 = NO2; ΔНо298 = 33,5 кДж/моль.
б)
1/2 N2 + 3/2 H2 = NH3; ΔНо298 = -46 кДж/моль.в)
1/2 N2 + 1/2 O2 = NO; ΔНо298 = 90 кДж/моль.г)
H2 + 1/2 O2 = H2O; ΔНо298 = -286 кДж/моль.9.6. Сколько энергии надо затратить для разложения 9 г воды на водород и кислород в стандартных условиях?
9.7. Даны стандартные энтальпии следующих реакций:
H2 = H + H (ΔНо298 = 436 кДж/моль)
Cl2 = Cl + Cl (ΔНо298 = 243 кДж/моль)
Стандартная энтальпия образования
HCl составляет -92 кДж/моль. Рассчитайте энергию связи в молекуле HCl.9.8. Исходя из термохимических уравнений реакций
KClO3 = KCl + 3/2 O2 (ΔНо298 = -49,4 кДж/моль);
KСlO
4 = KCl + 2 O2 (ΔНо298 = 33 кДж/моль),рассчитайте ΔНо
298 для реакции: 4 KClO3 = 3 KClO4 + KCl._________________