§9.6 Катализ.
Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами).
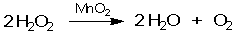
Каталитические реакции весьма распространены в химии и некоторые из них можно провести даже в домашних условиях. Например, 3%-ный раствор перекиси водорода (именно такой продают в аптеках) вполне устойчив в отсутствие примесей. Но при добавлении очень небольшого количества (нескольких крупинок) твердого диоксида марганца MnO2 начинается реакция разложения Н2О2 с выделением газообразного кислорода:

Здесь MnO2 - катализатор реакции. Можно заметить, что в химическом уравнении катализатор не присутствует среди реагентов или продуктов, его не нужно учитывать и при уравнивании реакции. Поэтому обычно катализатор в уравнении указывают над стрелкой. Если у вас под рукой нет диоксида марганца, его вполне можно заменить двумя-тремя крупинками марганцовки из домашней аптечки: KMnO4 при действии Н2О2 быстро превратится в MnO2 (полезно написать уравнение этой реакции). Дальше полученный катализатор, вне зависимости от его количества, будет работать до тех пор, пока не закончится весь реагент - перекись водорода. Этот опыт можно проводить дома только с разбавленным (аптечным) раствором перекиси водорода. С концентрированным раствором реакция идет очень бурно. Диоксид марганца - не единственный катализатор реакции разложения перекиси водорода. Биологические катализаторы (ферменты), содержащиеся в крови, действуют так же. Именно поэтому слабый раствор перекиси водорода, нанесенный на царапину, начинает пузыриться (выделяющийся при этом кислород дезинфицирует ранку).
Другой домашний опыт - каталитическое окисление сахарозы кислородом воздуха. Обычный кусковой сахар или сахар-рафинад представляет собой практически чистую сахарозу С12Н22О11. Кусочек сахара не удается поджечь на открытом огне - он плавится, но не загорается. Но если сахар «испачкать» катализатором - табачным пеплом - его удается поджечь.

Этот опыт иногда показывают как фокус - кусочек сахара «случайно» роняют в пепельницу, а затем поджигают. Предполагают (хотя это не установлено точно), что катализатором реакции окисления сахарозы служат соединения цезия, в очень небольшом количестве присутствующие в пепле от сигарет.
Удивительным в явлении катализа является то обстоятельство, что катализаторы, активно участвуя в реакции, сами в итоге не изменяются. Другими словами, катализаторы не расходуются в ходе химической реакции. Поскольку катализатор способен многократно участвовать в промежуточных химических взаимодействиях с реагентами, его часто берут в небольшом количестве - значительно меньшем по сравнению с реагентами.
В качестве катализаторов часто выступают обычные кислоты, основания, оксиды металлов или сами металлы. Но бывают и сложные катализаторы, поиск и приготовление которых требуют большого труда.
Различают положительный катализ (ускорение реакций) и отрицательный катализ (замедление реакций). Обычно термин «катализ» относят именно к положительному катализу, а отрицательный называют ингибированием. Соответственно «отрицательные катализаторы» называются ингибиторами. Например, в качестве ингибитора реакции разложения перекиси водорода используют очень небольшую (1 : 10000) добавку пирофосфата натрия Na4P2O7. Его роль заключается в связывании следов примесей, которые являются хорошими катализаторами реакции разложения перекиси водорода - соединений Cu, Mn и некоторых других тяжелых металлов.
Катализаторами называются вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
Еще одно важное свойство катализаторов заключается в способности повышать избирательность протекания реакций. Если какие-то реагенты могут реагировать между собой по разным направлениям (то есть давать несколько различных продуктов), то с участием катализаторов во многих случаях образуется только какой-то один продукт реакции. Избирательное протекание реакции называется селективностью. Таким образом, главные полезные свойства катализаторов заключаются в повышении скорости и селективности химических реакций.
В качестве примера рассмотрим реакцию разложения этилового спирта СН3СН2ОН (этанола). Без катализатора эта реакция идет с трудом (нужна высокая температура) и не селективно. Один путь реакции приводит к образованию этилена Н2С=СН2 и воды Н2О, другой - уксусного альдегида СН3СНО и водорода Н2:
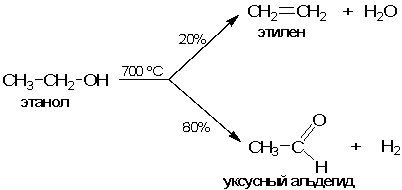
При пропускании паров этанола через накаленную до 700 оС стеклянную трубку обе реакции идут параллельно. Примерно 20% этанола превращается в этилен и воду, а 80% - в уксусный альдегид и водород. Такие жесткие условия характерны для реакций с высокой энергией активации Еа. В свою очередь, Еа тем выше, чем более неустойчивыми являются промежуточные соединения, образующиеся на пути от реагентов к продуктам.
Образование этилена из этанола без катализатора идет с образованием очень неустойчивых промежуточных продуктов. Применение катализатора - твердого оксида алюминия Al2O3 - заставляет реакцию идти по другому пути, где промежуточные продукты уже более устойчивы и, следовательно, меньше энергия активации реакции (рис. 9-12).
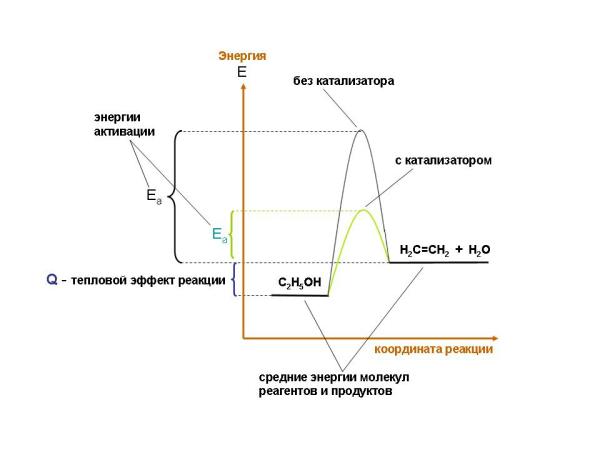
Рис. 9-12. В присутствии катализатора Al2O3 реакция разложения этанола протекает по пути с меньшей энергией активации Еа, чем без катализатора. Тепловой эффект реакции при этом не меняется. Подобная закономерность характерна не только для эндотермических, но и для экзотермических реакций.
В присутствии Al2O3 реакция заметно ускоряется и уже нет необходимости нагревать наполненную катализатором трубку до 700 оС - реакция с хорошей скоростью идет при 300 оС. Но это еще не весь эффект от применения катализатора! Реакция теперь идет с образованием этилена и воды, а уксусный альдегид и водород в этом случае не образуются. Таким образом, катализатор позволяет проводить реакцию разложения этанола селективно:
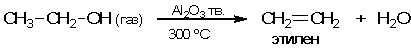
В приведенном примере реагент (этанол) и катализатор (порошкообразный оксид Al2O3) при 300 оС находятся в разных фазах - газообразной и твердой. В этом случае мы имеем дело с гетерогенным катализом. Если же реагенты и катализатор находятся в одной фазе - например, оба являются газами или оба растворены в каком-либо растворителе - то говорят о гомогенном катализе.
Как же работают катализаторы? Ответ на этот вопрос известен далеко не всегда. Однако в ряде случаев каталитические превращения изучены хорошо и химикам понятен механизм этих реакций. Термин «механизм реакции» раньше нам не встречался, поэтому необходимо объяснить его значение. Выяснение механизма реакции – это установление строения короткоживущих промежуточных частиц, возникающих на пути от реагентов к продуктам реакции. Такие неустойчивые промежуточные вещества часто невозможно выделить, но они могут быть изучены косвенными методами. Именно от строения и устойчивости (или неустойчивости) промежуточных частиц зависит скорость любой реакции и выбор того или иного её направления.
Например, использование серной кислоты H2SO4 в качестве гомогенного катализатора позволяет получать этилен из этанола уже при 170 оС. Это говорит о еще более значительном снижении энергии активации и ускорении реакции:
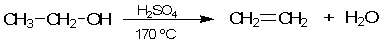
Реакцию проводят в растворе. Катализатором здесь является даже не сама серная кислота, а образующиеся при ее диссоциации ионы водорода Н+ (первая строчка в приведенной ниже схеме):
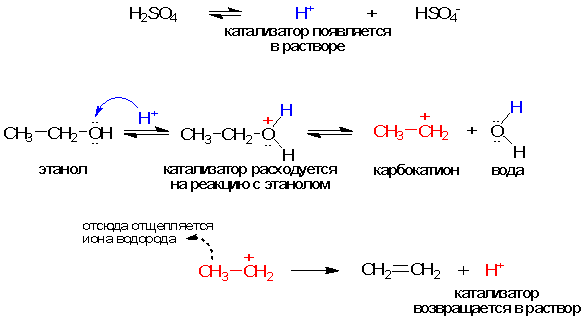
Разрыв связи С-О в этаноле происходит с образованием двух частиц, из которых неустойчива только одна (карбокатион), а вторая (Н2О), напротив, очень устойчива. Это приводит к общему снижению энергии активации по сравнению с реакцией без катализатора, где разрыв связи С-О происходит, вероятно, с образованием гораздо более неустойчивых частиц.
Далее образовавшийся карбокатион способен превращаться в устойчивое нейтральное соединение (этилен), отщепляя ион водорода Н+ (последняя строчка в схеме). Таким образом, катализатор Н+ возвращается в среду и опять готов к работе. Мы видим, что в реакционную среду в виде иона Н+ вернулся уже не тот атом водорода, который начинал реакцию. Но серной кислоте безразлично происхождение своих водородных атомов - в ходе реакции она осталась неизменной.
** Читателям, уже знакомым с органической химией, может показаться странным, что мы называем эту реакцию гомогенной. Каким образом этанол при 170 оС может оставаться в растворе? Ведь температура его кипения даже ниже, чем у воды: 78 оС. Однако ошибки здесь нет. Дело в том, что серную кислоту при получении этилена используют не только как катализатор, но и как растворитель. Отогнать этанол из такого раствора практически невозможно - раньше начинается реакция его разложения (дегидратации). Выделяющаяся вода поглощается серной кислотой с выделением энергии, поэтому энергетический профиль реакции, строго говоря, уже не такой, как показан на рис. 9-12. Но сути дела это не меняет: ускорение реакции достигается за счет снижения энергии активации реакции дегидратации по сравнению с такой же реакцией без катализатора.

Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 23 Мб).
Итак, катализатор не только увеличивает скорость реакции за счет снижения энергии активации Еа, но и задает строго определенный механизм (строение промежуточных частиц), заставляющий реакцию протекать селективно - в данном случае с образованием этилена и воды. Уксусный альдегид и водород в присутствии серной кислоты не образуются.
Интересно, что при использовании в качестве катализатора металлической меди превращение этанола удается селективно направить по другому пути - с образованием уксусного альдегида и водорода. В данном случае мы имеем дело уже с гетерогенным катализом:
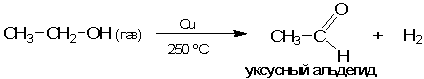
** Эта реакция называется реакцией дегидрирования (отщепления водорода). Она такая же эндотермическая, как и реакция дегидратации (отщепления воды). Однако при каталитическом дегидрировании, по сравнению с реакцией без катализатора, возникает новый, весьма важный фактор: выделяющийся в реакции водород тут же окисляется на меди кислородом воздуха с выделением большого количества теплоты. Это приводит к тому, что суммарный тепловой эффект всей последовательности реакций оказывается экзотермическим. Избыточной теплоты выделяется так много, что медная спираль (катализатор) в ходе реакции раскаляется.

Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 16 Мб).
Такую же реакцию дегидрирования (отщепления молекулы водорода) можно осуществить и с другим гетерогенным катализатором - нагретой серебряной сеткой. Приведенные выше примеры показывают, как с помощью катализаторов можно управлять селективностью реакций.
Если механизмы многих гомогенных каталитических реакций с участием кислот (кислотный катализ) или оснований (основной катализ) хорошо изучены, то о гетерогенном катализе этого сказать нельзя. Однако некоторые его закономерности все же известны.
Во-первых, в гетерогенном катализе большую роль играет адсорбция, то есть концентрирование веществ на поверхности раздела между ними. Например, адсорбция молекул газа происходит на поверхности твердого пористого катализатора. Благодаря адсорбции на поверхности катализатора растет концентрация реагирующих частиц, что уже само по себе может приводить к ускорению реакции. Поэтому важным фактором в гетерогенном катализе является площадь поверхности катализатора, его пористость. Чем больше поверхность, тем выше каталитическая активность твердого катализатора. Количество взятого катализатора тоже влияет на скорость реакции.
Во-вторых, еще более важную роль играет повышение химической активности адсорбированных молекул по сравнению с их обычным состоянием. Каким образом происходит повышение активности, понятно не всегда. Однако можно предположить, что образуются непрочные промежуточные соединения реагента с катализатором, в которых химические связи внутри реагента ослаблены и тем самым повышена его химическая активность. Вероятно, нечто похожее происходит в реакции присоединения водорода к соединениям с тройной связью (алкинам) на гетерогенном катализаторе - металлическом палладии с некоторыми добавками:
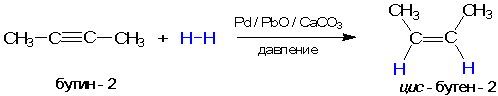
В этих реакциях образуются цис-алкены. Геометрическое строение продуктов реакции позволяет предположить, что молекула водорода присоединяется к алкину с поверхности катализатора. Если бы это было не так, то образовывался бы более устойчивый транс-алкен:
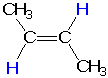
транс-бутен-2
** Справка для тех, кто еще не изучал органическую химию: цис-бутен и транс-бутен - разные соединения, хотя имеют одинаковую молекулярную формулу С4Н8 и даже одинаковую последовательность связывания атомов в молекулах. Это геометрические изомеры. Они отличаются геометрической формой своих молекул, поэтому их физические и даже некоторые химические свойства отличаются. В отличие от простых С-С связей, свободное вращение вокруг двойных С=С связей не происходит, поэтому цис- и транс-изомеры не переходят друг в друга в обычных условиях и существуют как индивидуальные соединения.
Еще одна особенность гетерогенного катализа заключается в том, что около поверхности работающего катализатора всегда концентрируются как исходные вещества, так и продукты реакции. Если продукты адсорбируются на катализаторе слишком прочно, то они плохо вытесняются с поверхности и катализатор постепенно теряет активность. В этом случае говорят, что катализатор отравляется продуктами реакции. Однако во многих случаях каталитическими ядами являются даже не продукты реакции, а различные примеси в исходных веществах. Например, для платиновых катализаторов такими каталитическими ядами являются примеси HCN, H2S, соединений As, Se, Te.
В ряде случаев катализатор специально «отравляют» - то есть частично подавляют его активность дозированным введением каталитических ядов, чтобы заставить реакцию идти в нужном направлении. Например, рассмотренная выше реакция присоединения водорода к тройной связи с не "отравленным" палладиевым катализатором не останавливается на стадии получения алкенов (соединений с двойной связью) и дает алканы:
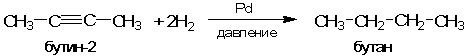
Добавление к измельченному палладию оксида свинца PbO и некоторых других каталитических ядов позволяет остановить реакцию гидрирования на стадии получения соединений с двойной связью. Поиск и приготовление таких катализаторов - настоящее искусство, поэтому не удивительно, что многие катализаторы носят имена своих создателей. Например, палладиевый катализатор для неполного восстановления алкинов называется катализатором Линдлара.
Наибольшее применение гетерогенный катализ находит в промышленном производстве органических веществ. Однако не менее необходим он и при получении таких важных неорганических продуктов, как аммиак NH3 и оксид серы SO3 (последний нужен для производства серной кислоты).
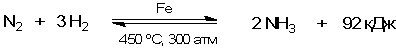
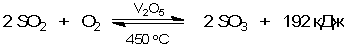
Обе эти промышленные реакции - экзотермические, то есть энергетически выгодные. Но есть и осложняющее обстоятельство: обе реакции обратимы, то есть одновременно протекают как в прямом, так и в обратном направлении. Более подробно такие реакции мы рассмотрим в следующем параграфе. Здесь лишь скажем, что сдвиг равновесия в сторону NH3 или SO3 становится возможен только при отводе образующегося в реакциях тепла, то есть при относительном снижении температуры этих реакций. Однако с понижением температуры реакции настолько замедляются, что равновесие устанавливается очень медленно. Поэтому необходимо применение катализаторов. Катализатор не способен влиять на положение равновесия, так как он одинаково хорошо ускоряет как прямую, так и обратную реакции. Однако благодаря катализатору равновесие устанавливается быстрее.
В синтезе аммиака применяется не чисто железный катализатор, а с добавками оксидов Al2O3 и K2O. Эти оксиды служат промоторами.
Промоторы - это вещества, сами по себе не являющиеся катализаторами данной реакции, но усиливающие действие основного катализатора.
В производстве серной кислоты для получения SO3 раньше в качестве катализатора использовали металлическую платину. На современных сернокислотных заводах работают значительно более дешевые ванадиевые катализаторы (V2O5) с добавками SiO2 и K2О.
Среди веществ, которые не следует путать с катализаторами, следует упомянуть инициаторы химических реакций. В отличие от катализаторов, инициаторы расходуются в ходе реакции, но их требуется очень немного, поскольку они служат всего лишь «спусковым крючком» начала химического процесса. Например, полимеризацию этилена можно осуществить в присутствии небольшого количества вещества-инициатора, способного распадаться с образованием свободных радикалов - частиц с неспаренным электроном. Такой активный радикал (например, RO.), присоединяясь к единственной молекуле этилена, способен вызвать множество последующих реакций присоединения других молекул этилена:
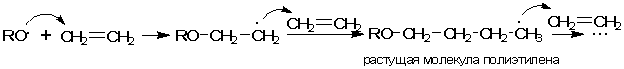
В более короткой форме реакцию получения полиэтилена можно выразить уравнением:
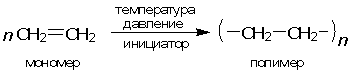
Индекс n в формуле полимера называется степенью полимеризации (значение n может достигать десятков тысяч). В результате происходящей сшивки молекул этилена образуются длинные макромолекулы полиэтилена с молекулярной массой от 30000 до 800000 в зависимости от условий реакции. На конце каждой такой гигантской молекулы имеется «пришитый» к ней инициатор, однако его содержание в общей массе полиэтилена ничтожно мало.
Инициаторы - вещества, в ряде случаев необходимые для возбуждения химической реакции, которая далее происходит без посторонней помощи. Инициаторы расходуются в ходе реакции, однако их требуется намного меньше, чем реагентов.
Впрочем, инициирование возможно и на поверхности гетерогенного катализатора. В этом случае говорят уже не об инициаторах, а о катализаторах полимеризации - такие тоже широко применяются в химической промышленности.
В одном параграфе невозможно рассмотреть все многообразие каталитических реакций, известных в неорганической и органической химии, в биохимии (ферментативный катализ), в технике (автомобильные катализаторы дожигания выхлопных газов) и т.д. Здесь мы ставили задачу разобраться лишь в некоторых ключевых вопросах, а именно:
Рекомендуем читателю еще раз вернуться к этим вопросам и ответить на них самостоятельно для закрепления пройденного материала.
_________________